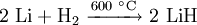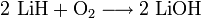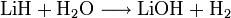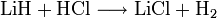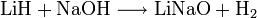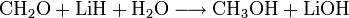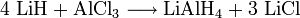- LiH
-
Kristallstruktur 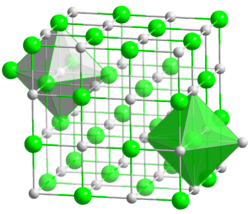
__ Li+ __ H- Allgemeines Name Lithiumhydrid Verhältnisformel LiH CAS-Nummer 7580-67-8 Kurzbeschreibung weißlich-graues Pulver Eigenschaften Molare Masse 7,95 g·mol−1 Aggregatzustand fest
Dichte 0,76 g·cm–3[1]
Schmelzpunkt Siedepunkt Löslichkeit reagiert mit allen protischen Lösungsmitteln teils sehr heftig
Sicherheitshinweise Gefahrstoffkennzeichnung [1] 

Leicht-
entzündlichÄtzend (F) (C) R- und S-Sätze R: 15-34 S: 7/8-26-36/37/39-43-45 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Lithiumhydrid LiH ist eine salzartige chemische Verbindung von Lithium und Wasserstoff. Da es sehr leicht und stabil ist, stellt es einen hervorragenden Wasserstoffspeicher mit einer Kapazität von 2,8 m3 H2/kg LiH dar. Der Wasserstoff kann durch Reaktion mit Wasser freigesetzt werden.[2]
Inhaltsverzeichnis
Vorkommen
Da Lithiumhydrid hochreaktiv ist, wird es ausschließlich synthetisch aus Lithium hergestellt. Wichtige Lithium-Mineralien sind Spodumen LiAlSi2O6 und Lepidolith (Lithionglimmer) ein Kalium- und Fluor-haltiges Lithium-Aluminium-Silicat.
Gewinnung und Darstellung
Lithiumhydrid wird durch die Umsetzung von metallischem Lithium mit molekularem Wasserstoff bei 600 °C hergestellt.[2]
Eigenschaften
Physikalische Eigenschaften
Lithiumhydrid ist ein weißes bis graues, brennbares Pulver, das mit einer Dichte von 0,76 g/cm3 einer der leichtesten Feststoffe ist. Es schmilzt bei 688 °C und siedet bei 850 °C unter Zersetzung.[1]
Chemische Eigenschaften
Lithiumhydrid ist brennbar:[1]
Es reagiert mit Wasser, Säuren und Basen unter Freisetzung von Wasserstoff:[2]
Es reduziert beziehungsweise hydriert organische Verbindungen, zum Beispiel Formaldehyd zu Methanol:
Verwendung
Lithiumhydrid dient als Reduktionsmittel zur Herstellung von Hydriden und Doppelhydriden.[2] Des Weiteren wird es zur Deprotonierung CH-acider Verbindungen benutzt. Ein weiteres Einsatzgebiet ist mit der Herstellung der Hydriermittel Lithiumboranat und Lithiumalanat gegeben.[2]
In Wasserstoffbomben dient Lithiumdeuterid, das deuterierte Lithiumhydrid, als Fusionsmaterial.[3]
Referenzen
Wikimedia Foundation.