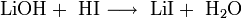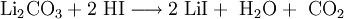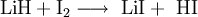- Lithiumjodid
-
Kristallstruktur 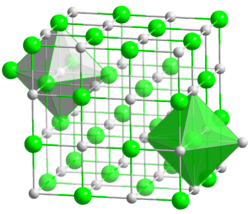
__ Li+ __ I- Kristallsystem kubisch Raumgruppe 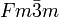
Koordinationszahlen Li[6], I[6] Allgemeines Name Lithiumiodid Andere Namen Lithiumjodid
Verhältnisformel LiI CAS-Nummer - 10377-51-2 (wasserfrei)
- 17023-25-5 (Hydrat)
Kurzbeschreibung farblose, sich gelblich färbende Kristalle Eigenschaften Molare Masse 133,85 g·mol–1 Aggregatzustand fest
Dichte 3,49 g·cm–3[1]
Schmelzpunkt Siedepunkt 1180 °C[1]
Löslichkeit Sicherheitshinweise Gefahrstoffkennzeichnung [1] 
Giftig (T) R- und S-Sätze R: 61-36/37/38 S: 22-26 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Lithiumiodid, LiI, ist das Lithiumsalz der Iodwasserstoffsäure. Neben dem wasserfreien Lithiumiodid existieren noch verschiedene Hydrate, bekannt sind LiI·nH2O mit n= 0,5, 1, 2 und 3.[3]
Inhaltsverzeichnis
Herstellung
Die Herstellung von Lithiumiodid erfolgt durch Umsetzung wässriger Lithiumhydroxid- oder Lithiumcarbonatlösungen mit Iodwasserstoff und anschließender Aufkonzentrierung und Trocknung.[3]
Das wasserfreie Lithiumiodid kann auch durch Reaktion von Lithiumhydrid mit Iod in wasserfreiem Diethylether hergestellt werden.[4]
Eigenschaften
Lithiumiodid bildet farblose, stark hygroskopische Kristalle mit einem Schmelzpunkt von 446 °C, einem Siedepunkt von 1180 °C und einer Dichte von 3,49 g·cm-3. Die molare Masse des wasserfreien Lithiumiodids beträgt 133,85 g/mol. Durch die Oxidation von Iodid zu Iod durch Luftsauerstoff färben sich die Kristalle schnell gelblich bis bräunlich.[3]
Das Trihydrat weist einen Schmelzpunkt von 72 °C auf. Beim Erhitzen verliert es bei 80 °C zwei Moleküle Kristallwasser und bei 300 °C ein Molekül Kristallwasser.[5] Lithiumiodid ist gut in Wasser (1650 g/l Wasser bei 20 °C) und Ethanol löslich.
Verwendung
Das wasserfreie Lithiumiodid wird für organische Synthesen verwendet[3], in Batterien dient es als Elektrolyt.[6] Dotierte Kristalle dienen als Szintillationsdetektor für langsame Neutronen.[7]
Quellen
- ↑ a b c d e Eintrag zu Lithiumiodid in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 04.08.2008 (JavaScript erforderlich)
- ↑ G. Milne: Gardner's Commercially Important Chemicals: Synonyms, Trade Names, and Properties. S. 370, Wiley-IEEE, 2005, ISBN 9780471736615
- ↑ a b c d A. F. Holleman, E. Wiberg, N. Wiberg, Lehrbuch der Anorganischen Chemie 1995, 101. Auflage, de Gruyter. ISBN 3-11-012641-9, S. 1151–1152.
- ↑ M. D.Taylor, L. R. Grant: New Preparations of Anhydrous Iodides of Groups I and II Metals, in: J. Am. Chem. Soc. 1955, 77, 1507–1508
- ↑ G. F. Hüttig, F. Pohle: Studien zur Chemie des Lithiums. II. Über die Hydrate des Lithiumjodids, in: Z. anorg. allg. Chem. 1924, 138, 1–12.
- ↑ L. F. Trueb, P. Rüetschi: Batterien und Akkumulatoren - Mobile Energiequellen für heute und morgen., Springer, Berlin 1998 ISBN 3-540-62997-1.
- ↑ K. P. Nicholson: Some lithium iodide phosphors for slow neutron detection, in: J. Appl. Phys. 1955 , 6, 104–106.
Wikimedia Foundation.