- Magnesiumcarbonat
-
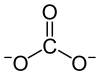
Strukturformel 
Allgemeines Name Magnesiumcarbonat Andere Namen - Magnesit
- Magnesia alba
- E504
Summenformel MgCO3 CAS-Nummer 546-93-0 ATC-Code Kurzbeschreibung farbloses Pulver[1]
Eigenschaften Molare Masse 84,31 g·mol−1[1] Aggregatzustand fest
Dichte 2,96 g·cm–3 (20 °C)[1]
Schmelzpunkt > 350 °C (Zersetzung)[1]
Löslichkeit schlecht (0,106 g·l−1) in Wasser[1]
Sicherheitshinweise Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln EU-Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Magnesiumcarbonat, MgCO3, kommt in der Natur in großen Mengen als Magnesit oder Bitterspat (MgCO3 · H2O) mit der Härte 4–4½ vor. Es ist neben Dolomit das wichtigste Magnesium-Mineral. Das neutrale Magnesiumcarbonat geht, besonders in der Wärme, in basisches Magnesiumcarbonat über:

Magnesiumcarbonat ist zusammen mit Calciumcarbonat (Kalk) hauptsächlich für die Entstehung der Wasserhärte verantwortlich.
Inhaltsverzeichnis
Verwendung
Magnesiumcarbonat kommt als kristallwasserhaltiges 4 MgCO3 · Mg(OH)2 · 4-5 H2O als Magnesia alba, helle Magnesia, in den Handel (CAS-Nummer 12125-28-9). Eine wässrige Suspension von 50g/l Wasser reagiert basisch und hat einen pH von etwa 10,5.
Lebensmittel
Hauptbestandteil in vielen Mineral- und Heilwässern.
Lebensmittelzusatzstoff
In der Lebensmittelindustrie wird Magnesiumcarbonat Lebensmitteln als Säureregulator, Trägerstoff oder Trennmittel zugesetzt. Es gilt als gesundheitlich unbedenklich. Große Mengen können jedoch abführend wirken.
In der EU ist es als Zusatzstoff mit der Nummer E 504 ohne Höchstmengenbeschränkung für alle für Zusatzstoffe zugelassenen Lebensmittel – auch für „Bio“-Produkte – zugelassen.
Isolier- und Füllstoff
Es wird in Wärmeisoliermaterialien verwendet und als Füllstoff in Kunststoffen, Papier, Farben und Kautschuk sowie in der Kosmetik in Pudern.
Arzneimittel
Zusammen mit Calciumcarbonat wird Magnesiumcarbonat in Medikamenten zur Magensäureregulation (Antazida) eingesetzt, so z. B. im Produkt Rennie.
Sport
Magnesiumcarbonat wird von den Produzenten unter den Namen Magnesiumcarbonat, Magnesia oder Chalk vertrieben und von Gerätturnern, Kraftsportlern und Kletterern verwendet, um die Griffigkeit der Hände zu erhöhen und den auftretenden Handschweiß zu trocknen. Es ist in gepresster Blockform, als lockeres Pulver und neuerdings auch flüssig in Alkohol suspendiert erhältlich.
Sportklettern
Im Sportklettern wurde es erstmals von John Gill für das Bouldern verwendet, der die Idee aus dem Geräteturnen mitbrachte.
Die Magnesia wird dabei in verschließbaren, tragbaren Beuteln, so genannten Chalkbags, mitgeführt. Sie sind am Klettergurt hinten, auf Steißbeinhöhe, angehängt. Sobald der Kletterer während des Kletterns feuchte Hände bekommt, kann er in den geöffneten Beutel greifen. Der Chalkbag wird in der Regel direkt mit Pulver oder zu Pulver zerriebenen Blöcken gefüllt. Als Alternative kann man im Beutel auch einen Chalkball mitführen. Das sind mit Magnesia gefüllte, dünne und durchlässige Stoffkugeln, welche den Vorteil eines geringeren Verbrauchs und einer verminderten Staubproduktion aufweisen. Da Staub in Kletterhallen ein Problem darstellen kann, gibt es einige Hallenordnungen, die nur Chalkballs erlauben und offene Magnesia verbieten.
In einigen Klettergebieten ist die Verwendung von Magnesia aus verschiedenen Gründen nicht gestattet oder zumindest nicht erwünscht:
- Die in den Griffen verbleibenden Reste von Magnesiumcarbonat „ziehen“ Wasser aus der Umgebung, was Griffe dauerfeucht / -rutschig und somit kein Klettern ohne Magnesia mehr möglich macht.
- Das „gezogene“ Wasser geht in den Stein, bei Frost gewinnt es an Volumen und kann in bestimmten Gebieten (z.B. Sandstein) die Steinoberfläche zerstören.
- Optische Beeinträchtigung der Felsoberfläche (weiße Flecken an den Felsen). Kritiker verweisen darauf, dass Magnesia auch eingefärbt werden könne.
- Langfristige Veränderung der physikalischen und chemischen Eigenschaften des Felses (Reduzierung der Reibung, chemische Umwandlung der Mineralien). Kritiker werfen ein, dass dies nur den Sandstein betreffe und auch dort hauptsächlich auf Vermutungen gestützt sei.[2].
- Landschaftsschutz: Das an begehrten Routen umfangreiche Einbringen eines basischen Magnesiumdüngers bewirkt an nicht dazu passenden Standorten eine Veränderung der Vegetation.
- Reduzierung der sportlichen Anforderungen: Durch die wissentliche oder auch nur als Nebeneffekt der Magnesiaverwendung erzielte Markierung der Griffe am Fels wird deren Auffinden erleichtert, womit die sportliche Herausforderung gesenkt wird.
Geräteturnen und Kraftsport
Im Turnen und auch im Kraftsport wird die Magnesia in Behältern nahe dem Leistungsort aufgestellt. Die Athleten trocknen sich dann darin vor dem Übungsbeginn die Hände.
Feuerfest-Produkte
Vor allem in der Stahl- und Eisenindustrie (Stahlgießpfannen oder Elektroöfen), aber auch in der Zement- oder Glasindustrie (Auskleidung von Drehrohröfen oder Glasschmelzöfen) werden Feuerfestmaterialien aus Magnesit gefertigt. Das Magnesit wandelt sich bei Erhitzung unter Abgabe von Kohlendioxid in Magnesiumoxid um. Der weltweit größte und bedeutendste Hersteller ist die RHI AG, die aus dem Veitsch-Radex-Konzern hervorging. Das Stammwerk mit der dazugehörenden Magnesitlagerstätte befindet sich auf der Millstätter Alpe in Radenthein/Kärnten.
Magnesit ist ein Zuschlagstoff oder alleiniger Ausgangsstoff für technische Keramik, für feuerfeste Tiegel und Stäbchen. Hier wandelt sich das Magnesit beim Brennen in Magnesiumoxid-Keramik um oder es wird vorher gebrannt und als Magnesiumoxid in Pulverform eingesetzt.
Quellen
- ↑ a b c d e f Eintrag zu Magnesiumcarbonat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20.8.2008 (JavaScript erforderlich)
- ↑ Juliane Friedrich: Bergsport und Naturschutz in der sächsischen Schweiz -Wirkungen, Konflikte, Lösungsmöglichkeiten. 2, Diplomarbeit Technische Universität Dresden, Dresden 2002, S. 47f (http://www.ssi-heft.de/aktuell/diplom_juliane_friedrich_band_ii.pdf, abgerufen am 29. März 2008).
Kategorien:- ATC-A02
- ATC-A06
- ATC-A12
- Carbonat
- Magnesiumverbindung
- Arzneistoff
- Klettermaterial
- Lebensmittelzusatzstoff
- Pharmazeutischer Hilfsstoff
Wikimedia Foundation.

