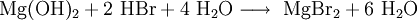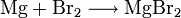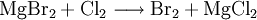- Magnesiumdibromid
-
Kristallstruktur 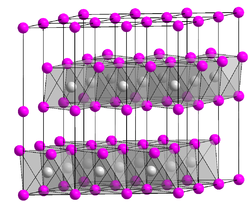
__ Mg+ __ Br- Allgemeines Name Magnesiumbromid Andere Namen - Magnesium(II)-bromid
- Magnesiumdibromid
Verhältnisformel MgBr2 CAS-Nummer 7789-48-2 (13446-53-2 als Hexahydrat) Kurzbeschreibung farbloses, hygroskopisches Pulver Eigenschaften Molare Masse 184,113 g/mol Aggregatzustand fest
Dichte Schmelzpunkt 711 °C[1]
Siedepunkt 1158 °C[1]
Löslichkeit löslich in Wasser
Sicherheitshinweise Gefahrstoffkennzeichnung [2] 
Reizend (Xi) R- und S-Sätze R: 36/37/38 S: 26-36 WGK 1[2] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Magnesiumbromid ist eine chemische Verbindung des Magnesiums aus der Gruppe der Bromide mit der Summenformel MgBr2.
Inhaltsverzeichnis
Vorkommen
Magnesiumbromid kommt natürlich in Abraumsalzen von Kalisalzlagerstätten (Bromide kommen in Kalisalzen etwa im Verhältnis von 1:300 zu den analogen Chloriden vor) und im Meerwasser (in einer Konzentration von etwa 70g/m³) vor[3].
Gewinnung und Darstellung
Es existieren einige Möglichkeiten zur Herstellung von Magnesiumbromid. Zum einen kann Magnesiumbromid durch Reaktion einer Magnesiumhydroxidlösung (gewonnen aus Magnesiumchlorid) mit Bromwasserstoff gewonnen werden.
Eine weitere Möglichkeit ist durch die Darstellungen aus den Elementen gegeben. Diese Reaktion wird in wasserfreiem Diethylether durchgeführt, da das direkte Zutropfen elementaren Broms auf metallisches Magnesium eine zu heftige Reaktion verursachen würde.
Eigenschaften
Physikalische Eigenschaften
Es ist ein farbloses, hygroskopisches Pulver und tritt auch als Hexahydrat auf, welches bei 165 °C zu wasserfreiem Magnesiumbromid dehydratisiert. Magnesiumbromid kristallisiert in der Cadmiumiodid-Struktur.
Verwendung
Magnesiumbromid kann zur Herstellung von Brom aus bromidhaltigen Laugen verwendet werden.
Weiterhin wird es bei organischen Synthesen eingesetzt[4].
Quellen
- ↑ a b c Datenblatt bei WebElements (englisch)
- ↑ a b c Datenblatt bei Sigma Aldrich
- ↑ Brom bei Seilnacht
- ↑ Script zur Herstellung von Alkoholen durch Grignardreaktion
Literatur
- Brauer, Handbuch der Präparativen Anorganischen Chemie, Band 2, 3. Auflage, S.905ff
Wikimedia Foundation.