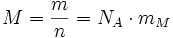- Molekulargewicht
-
Die molare Masse (auch Molmasse; unüblich stoffmengenbezogene Masse) hat das Formelzeichen M und die Einheit Gramm pro Mol (Einheitenzeichen: g/mol). Die molare Masse ist der Quotient aus der Masse und der Stoffmenge einer Substanz. Wie bei allen molaren Größen, bei denen man sich auf die Basisgröße Stoffmenge bezieht, müssen die zugrunde gelegten Teilchen der Substanz spezifiziert sein, am besten durch eine Formel. So muss beispielsweise zwischen der molaren Masse eines Wasserstoffatoms H und der molaren Masse eines Wasserstoffmoleküls H2 unterschieden werden, auch wenn man sprachlich nur „Wasserstoff“ angibt.
Gegenüber der Masse ist die molare Masse keine extensive Größe, sondern eine Stoffkonstante, also eine intensive Größe. Die früher üblichen Bezeichnungen Atomgewicht, Molekulargewicht und Molgewicht sind irreführend, da Gewicht und hier gemeinte Kraft aufgrund der Gravitation ortsabhängig sind.
Inhaltsverzeichnis
Definition
Ein Mol einer Substanz ist die Stoffmenge, die aus ebenso vielen Teilchen besteht, wie in zwölf Gramm des Kohlenstoff-Isotops 12C Atome enthalten sind. Diese Teilchenzahl beträgt etwa 6,022·1023; sie ist identisch mit dem Zahlenwert der Avogadro-Konstante (NA) in der Einheit mol−1.
Hierbei stehen die einzelnen Formelzeichen für folgende Größen:
- m – Masse
- n – Stoffmenge
- NA – Avogadro-Konstante
- mM – Molekülmasse
In der Physik wird die Avogadrokonstante gelegentlich auch unter Verwendung der Einheit kmol−1 als 6,022·1026 kmol−1 geschrieben; dann stellen sich nämlich handliche Zahlenwerte für die Masse in der SI-Basiseinheit Kilogramm ein. Beispiel:
- 6,022·1023 12C-Atome haben eine Masse von 12 g
- 6,022·1026 12C-Atome haben eine Masse von 12 kg
Berechnung molarer Massen
Die molare Masse einer Verbindung kann berechnet werden, wenn man ihre Summenformel kennt: Zu jedem Element entnimmt man aus der Summenformel den stöchiometrischen Koeffizienten – er steht in der Summenformel hinter dem Elementsymbol. Zu jedem Element muss man dann z.B. aus Tabellen die molare Masse entnehmen – ihr Zahlenwert ist gleich der relativen Atommasse. Dann erhält man die molare Masse als Summe der molaren Massen der Elemente, die die Verbindung aufbauen:
Die molare Masse einer Verbindung ist gleich der Summe aus den molaren Massen der Elemente multipliziert mit ihren stöchiometrischen Koeffizienten.
Beispiel: Wasser (H2O)
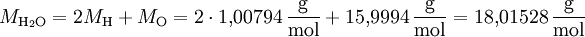
Beispiele
Aus den molaren Massen der chemischen Elemente kann man die molaren Massen aller Verbindungen berechnen.
Element Elementsymbol Ordnungszahl Molare Masse Wasserstoff H 1 1,00794 g/mol Kohlenstoff C 6 12,0107 g/mol Sauerstoff O 8 15,9994 g/mol Verbindung Summenformel Zahl der Atome Molare Masse Wasserstoff H2 2 2,01588 g/mol Sauerstoff O2 2 31,9988 g/mol Wasser H2O 3 18,01528 g/mol Methan CH4 5 16,043 g/mol Aspirin C9H8O4 21 180,16 g/mol Siehe auch
- Atomare Masseneinheit, Dalton
- Molares Volumen (Molvolumen)
Weblinks
Wikimedia Foundation.