- Acetylsalicylsäure
-
Strukturformel 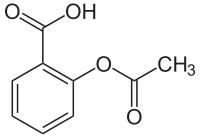
Allgemeines Name Acetylsalicylsäure Andere Namen Summenformel C9H8O4 CAS-Nummer 50-78-2 PubChem 2244 ATC-Code DrugBank APRD00264 Arzneistoffangaben Wirkstoffklasse Wirkmechanismus irreversibler Cyclooxygenasen-Inhibitor
Verschreibungspflichtig: Teilweise Eigenschaften Molare Masse 180,16 g·mol−1 Dichte Schmelzpunkt Siedepunkt zersetzt sich[1]
pKs-Wert 3,49[1]
Löslichkeit Sicherheitshinweise Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln GHS-Gefahrstoffkennzeichnung [1] 
Achtung
H- und P-Sätze H: 302-315-319-335 EUH: keine EUH-Sätze P: 261-305+351+338 [1] EU-Gefahrstoffkennzeichnung [1]
Xn
Gesundheits-
schädlichR- und S-Sätze R: 22 S: keine S-Sätze LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Acetylsalicylsäure, kurz ASS, ist ein weit verbreiteter schmerzstillender, entzündungshemmender, fiebersenkender und thrombozytenaggregationshemmender Wirkstoff, der seit 1977 auf der Liste der unentbehrlichen Arzneimittel der WHO steht. Der Stoff wurde Anfang des 20. Jahrhunderts als Aspirin vermarktet, wodurch diese Marke, die von der Bayer AG im Jahr 1899 geschützt wurde[6], bis heute zum Gattungsnamen für den Wirkstoff und ihn enthaltende Produkte wurde.
Inhaltsverzeichnis
Geschichte
Schon im antiken Griechenland wurde der Saft der Weidenrinde gegen Fieber und Schmerzen aller Art eingesetzt. Hippokrates von Kos, Dioscurides und auch der römische Gelehrte Plinius der Ältere sahen die Weidenrinde als Arznei an.[7] Durch Kochen von Weidenbaumrinden haben Germanen und Kelten Extrakte gewonnen und zu Heilzwecken verwendet, die der synthetischen Acetylsalicylsäure verwandte Substanzen enthielten. 1763 meldete der in Oxford lebende Geistliche Edward Stone der Royal Society in London, dass diese aus der Überlieferung bekannten Erkenntnisse korrekt seien.[7] 1828 gelang es Johann Andreas Buchner, das Salicin, einen chemischen Verwandten der ASS, der im Körper zu Salicylsäure umgesetzt wird, aus den besagten Weidenrindenextrakten (Weide, Salix sp.) zu isolieren.
Auch Bibergeil (Castoreum), ein Sekret der Analdrüse des Bibers, enthält Salicylsäure und wurde deshalb bis ins 19. Jahrhundert gegen Krämpfe, hysterische Anfälle, Nervosität u.v.m eingesetzt. Schon in der gräco-romanischen Antike wurde die Substanz gegen Epilepsie eingesetzt.
Die Salicylsäure selbst wurde seit 1874 durch Friedrich von Heyden großtechnisch in seiner Salicylsäurefabrik Dr. F. v. Heyden in Radebeul hergestellt und als Medikament eingesetzt - der bittere Geschmack der Substanz und Nebenwirkungen wie Magenbeschwerden jedoch schränkten die Einsatzmöglichkeiten stark ein.
Acetylsalicylsäure schließlich wurde, wenn auch in noch unreiner Form, erstmals 1853 von Charles Frédéric Gerhardt synthetisiert[7]. Die erste Reinsynthese von ASS dagegen erfolgte am 10. August 1897 im Bayer-Stammwerk in Elberfeld (im heutigen Wuppertal).
Sowohl Felix Hoffmann als auch Arthur Eichengrün werden als Erfinder diskutiert. Zuletzt kam 1999 Walter Sneader von der Abteilung Pharmazeutische Wissenschaften der Universität Strathclyde in Glasgow zu dem Ergebnis, dass Eichengrün der Erfinder des Aspirins sei – Bayer bestritt diese Theorie unmittelbar in einer Pressemitteilung[8]. Eichengrün wurde aufgrund seiner jüdischen Herkunft während der Nazizeit in seiner wissenschaftlichen Arbeit zunehmend behindert. Sicher ist, dass Eichengrün nach der Zulassung von Aspirin zum Leiter der pharmazeutischen Abteilung bei der Bayer AG befördert und Hoffmann Leiter der Marketing-Abteilung wurde. Bayer vermarktete jedoch vorerst den elf Tage später von Hoffmann entwickelten Hustenstiller, das als Heroin bekannt gewordene Diacetylmorphin (DAM) stärker, da man nach Versuchen an Menschen davon ausging, dass Aspirin zu viele Nebenwirkungen habe.
1949 veröffentlichte Arthur Eichengrün eine Arbeit, in der er schrieb, er habe die Entwicklung von Aspirin sowie einiger benötigter Hilfsstoffe geplant und koordiniert. Schon zuvor aus dem KZ – fast ein halbes Jahrhundert nach der Erfindung von Aspirin – schrieb Eichengrün der I.G. Farben (Bayer), als er sich, wie er selber sagte, seinem Tode nahe sah, dass Hoffmann an Aspirin nur in der Weise beteiligt war, dass er die Anordnungen Eichengrüns befolgte, ohne überhaupt zu wissen, was er im Auftrage Eichengrüns tat. Während des Nationalsozialismus wurde er weiterhin als Beteiligter oder gar Erfinder verleugnet, wie dies bei allen jüdischen Errungenschaften üblich war und öffentlich die Erfindung des Aspirins vor allem Hoffmann zugesprochen. Eichengrün hat dies selbst, nach seiner Entlassung, in einer noch aus Zeiten des Nationalsozialismus stammenden Ausstellung - über deren Pforte „Juden ist der Zutritt verboten“ prangte – auf einer Tafel zum Thema Aspirin gelesen. Auf ihr wurden Hoffmann und eine andere, mit der Entwicklung Aspirins nicht in Verbindung stehende Person als Erfinder genannt, ohne jegliche Erwähnung Eichengrüns. In vielen geschichtlichen Abhandlungen bzw. Lexika zu dem Thema wird aufgrund dieser Vorgänge während des Nationalsozialismus und der damit entsprechend beeinflussten Geschichtsbücher vornehmlich Felix Hoffmann als Erfinder oder wahrscheinlicher Erfinder genannt und die Erklärung Eichengrüns in seiner 1949 veröffentlichen Arbeit oftmals lediglich als Behauptung betitelt.
Das Produkt wurde 1897 Aspirin genannt. Der Name Aspirin leitet sich vom Echten Mädesüß, auch Spire genannt (veraltet: Spiraea ulmaria L. heute: Filipendula ulmaria (L.) Maxim.), einem salicylathaltigen Rosengewächs, ab: 'A' (für die Acetylgruppe), -'spirin' (für den Inhaltsstoff der Spire). Der Markenname Aspirin wurde am 6. März 1899 in die Warenzeichenrolle des Kaiserlichen Patentamtes aufgenommen und im selben Jahr vergeblich zum Patent angemeldet. Die Patente konnten jedoch nicht erteilt werden, da die Chemische Fabrik v. Heyden in Radebeul bei Dresden unter dem Chemiker Richard Seifert ebenfalls bereits seit 1897 die Acetylsalicylsäure, erst unter ihrem chemischen Namen und später unter dem Handelsnamen Acetylin, als Heilmittel produzierte und vertrieb.[9]
Namensgeber für die Marke Aspirin war Kurt Witthauer, Oberarzt der Inneren Abteilung am Diakonissenhaus in Halle/Saale, der die Substanz an 50 Patienten seiner Abteilung mit Erfolg testete und damit schließlich deren Produktion durchsetzte: „Auf Grund meiner günstigen Erfahrungen hat sich die Fabrik nach langem Zögern bereitfinden lassen, das Aspirin nunmehr in den Handel zu bringen, und ich will nur hoffen, dass die schwierige Herstellungsweise nicht einen allzu hohen Preis bedingt, damit dieses, wie ich glaube, wertvolle Mittel allgemein in Gebrauch genommen werden kann.[10]“
Nach dem Ersten Weltkrieg wurde Bayer im Rahmen des Versailler Vertrags gezwungen, das Patent und die Rechte an der Marke Aspirin für das Gebiet der Siegermächte USA, Frankreich und Großbritannien aufzugeben. In den USA kaufte das Pharmaunternehmen Sterling Drug 1918 von der US-Verwaltung für feindlichen Besitz die Markenrechte, verlor sie jedoch durch einen Gerichtsbeschluss in den 1950er Jahren wieder, so dass der Name „Aspirin“ in den USA gemeinfrei wurde. 1994 schließlich kaufte die Bayer AG das Unternehmen Sterling Drug von seinem vorübergehenden Eigentümer Kodak für 1 Milliarde Dollar, und seitdem verkauft Bayer in den USA wieder „Bayer-Aspirin“, das weltweit meistgekaufte ASS-Präparat.
Chemie
Struktur
Acetylsalicylsäure ist der Trivialname für 2-Acetoxybenzoesäure, wie sie nach den IUPAC-Regularien heißt. Dabei handelt es sich um ein Derivat der Salicylsäure (o-Hydroxybenzoesäure), womit die Acetylsalicylsäure sowohl als Benzoesäure (siehe IUPAC-Name) als auch als Ester der Essigsäure (Essigsäuresalicylester) aufgefasst werden kann. Die phenolische Hydroxygruppe in ortho-Stellung zur Carbonsäuregruppe der Salicylsäure reagiert mit der Carboxygruppe der Essigsäure. Das Gesamtmolekül hat einen hydrophilen und einen lipophilen Anteil.
Chemische und physikalische Eigenschaften
Acetylsalicylsäure liegt als weißes Pulver vor oder bildet flache bis nadelförmige Kristalle mit schwachem Geruch nach Essigsäure. Der pKs-Wert beträgt 3,5. Sie schmilzt bei einer Temperatur von 136 °C, bei Temperaturen über 140 °C tritt Zersetzung ein.[1] Acetylsalicylsäure ist gut löslich in Ethanol und Alkalilauge, aber schlecht löslich in Benzol oder kaltem Wasser (3,3 g·l−1 bei 20 °C), was auf den hydrophoben Benzolring zurückzuführen ist. Die Wasserlöslichkeit steigt erheblich beim Erwärmen. Aufgrund der erheblich besseren Wasserlöslichkeit werden therapeutisch auch das Magnesium- und Calciumsalz eingesetzt.[11] Die Dichte von Acetylsalicylsäure beträgt 1,35 g·cm−3, der Dampfdruck ist gering.
Herstellung
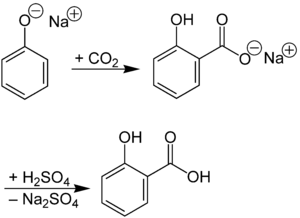
Die Ausgangssubstanz Salicylsäure (ortho-Hydroxybenzoesäure) wird industriell durch die Kolbe-Schmitt-Reaktion hergestellt. Dabei lässt man Natriumphenolat unter Druck mit Kohlendioxid reagieren.[12] Durch nachfolgende Protonierung mit einer Säure erhält man die o-Hydroxybenzoesäure (Salicylsäure).[13]
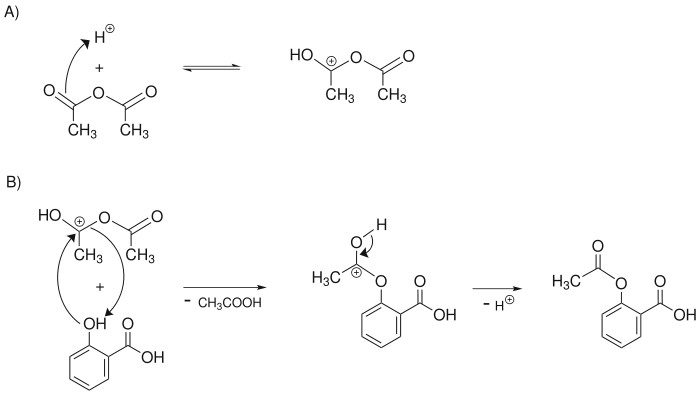
Anschließend wird die Salicylsäure mit protoniertem Essigsäureanhydrid an der phenolischen Hydroxygruppe zu Acetylsalicylsäure verestert (acetyliert):
Alternativ kann das Reaktionsprodukt aus Natriumphenolat und Kohlendioxid auch direkt mit Essigsäureanhydrid acetyliert werden, wobei Acetylsalicylsäure resultiert und Natriumacetat in stöchiometrischer Menge entsteht.[14]
Nachweis
Um Acetylsalicylsäure chemisch nachzuweisen, wird sie zunächst mittels alkalischer oder saurer Hydrolyse in Salicylsäure und Essigsäure gespalten. Als Katalysator wird entsprechend Natronlauge oder Salzsäure verwendet, in der die Substanz gekocht wird.[15] Ohne Erhitzen bildet sich in der Natronlauge lediglich das Natriumsalz, welches aufgrund seiner ionischen Eigenschaft in Lösung geht, jedoch nicht reagiert. Nach der Hydrolyse kann der Nachweis der freigesetzten Salicylsäure mit Eisen(III)-chlorid (FeCl3) (es entsteht ein rotvioletter Chelatkomplex)[16] oder Hydroxamsäurereaktion[17] erfolgen. Der Nachweis von Acetat oder Essigsäure erfolgt durch Geruchsprüfung, Veresterung mit Chlorethan (Entstehung von charakteristisch riechendem Ethylacetat)[18] oder Versetzen mit Lanthan(III)-Nitrat (La(NO3)3) und Iod (blaue Färbung).[19]
Die qualitative und quantitative Bestimmung der Acetylsalicylsäure in pharmazeutischen Zubereitungen oder im Blutplasma erfolgt vorzugsweise durch chromatographische Verfahren wie z. B. die HPLC, Gaschromatographie oder Gaschromatographie mit Massenspektrometrie-Kopplung.[20][21][22] Die hochspezifische Analytik der Salicylsäure - als Stoffwechselprodukt im Humanserum - kann durch Einsatz der HPLC mit Fluoreszenzdetektion erfolgen.[23]
Pharmakologie
Wirkungen
Acetylsalicylsäure wirkt durch Hemmung der Cyclooxygenase COX-1 schon in kleinen Dosen (30–50 mg) gerinnungshemmend, mit steigender Dosis (0,5–2 g) durch Hemmung der Cyclooxygenase COX-1 und COX-2 und der daraus folgenden, sinkenden Bildung von Prostaglandinen auch dezentral schmerzstillend, antirheumatisch sowie fiebersenkend und schließlich (2–5 g) entzündungshemmend. Prostaglandine sind unter anderem auch an der Regelung der Magensäuresekretion und der Magenschleimhautdurchblutung beteiligt, so dass durch die Hemmung der Prostaglandinsynthese bei höheren Dosierungen und längerfristiger ASS-Einnahme, beispielsweise im Rahmen der Behandlung von rheumatischen Beschwerden, Magenbeschwerden und Magenblutungen auftreten können. Die Magenunverträglichkeit beruht zu einem wesentlichen Teil auf der (gewünschten) systemischen Hemmung der Prostaglandinsynthese und lässt sich durch andere Darreichungsformen (magensaftresistente Tablette, Zäpfchen oder intravenöse Gabe) allenfalls abmildern. Eine Arzneiform, die auf der Magenschleimhaut aufliegend den Wirkstoff abgibt, beeinträchtigt das Gewebe des Magens kurzzeitig jedoch noch zusätzlich. Über die Hemmung der Prostaglandinsynthese kann die Acetylsalicylsäure auch die Entartung von gutartigen Darmgeschwülsten zu Krebs behindern. Bei der kurzzeitigen Anwendung in Dosierungen von 500–1000 mg bei akuten Schmerzen ist Acetylsalicylsäure in seiner Verträglichkeit in etwa mit den anderen apothekenpflichtigen Schmerzmitteln vergleichbar.
Wirkmechanismus
Die Funktionsweise der Acetylsalicylsäure, nämlich die Hemmung der Prostaglandinproduktion, wurde 1971 von John Robert Vane aufgeklärt,[24] wofür er 1982 zusammen mit Sune Bergström und Bengt Samuelsson den Nobelpreis für Medizin erhielt[25]:
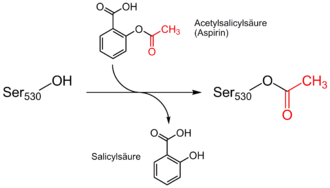
Die Wirkung der Acetylsalicylsäure beruht auf einer irreversiblen Hemmung der Prostaglandin-H2-Synthase, genauer der Cyclooxygenasen COX-1 und COX-2. Diese Enzyme katalysieren die Bildung von entzündungsverstärkenden Prostaglandinen sowie z. B Thromboxan A2, das u. a. thrombozytenaktivierend wirkt. Die Acetylsalicylsäure überträgt bei der Hemmung einen Acetylrest auf einen Aminosäurerest (Serin 530) kurz vor dem katalytischen Zentrum. Dadurch kann die Arachidonsäure als Substrat des Enzyms das aktive Zentrum nicht mehr erreichen und das Enzym wird dauerhaft inaktiviert. Die COX-1 wird durch Acetylsalicylsäure etwa 10–100 mal stärker gehemmt als die COX-2. Da Thrombozyten aufgrund des fehlenden Zellkerns keine Enzyme nachbilden können, ist die gerinnungshemmende Wirkung auf sie irreversibel – die Wirkungsdauer deckt sich daher mit der Überlebenszeit der Thrombozyten (8–11 Tage).
Ein weiterer indirekter Wirkmechanismus scheint die indirekte Hemmung der Cyclooxygenase zu sein: Aspirin verstärkt effektiv die Aktivität der Cytochrom P450-Isoformen CYP2E1 und CYP4A1 welche Arachidonsäure zu Epoxyeicosatriensäuren abbauen. Einige dieser Epoxyeicosatriensäuren gehören zu den endogenen Antipyretika, also Stoffen des Körpers, die die Fieberreaktion begrenzen; sie hemmen die Cyclooxygenase-2 effektiver als das Aspirin an sich.[26]
Pharmakokinetik
Acetylsalicylsäure unterliegt einem ausgeprägten First-pass-Metabolismus (z.T. schon in der Magen- und Darmwand durch spezielle Esterasen) und hat eine orale Bioverfügbarkeit von etwa 70 %. Im Körper wird sie innerhalb von 15 min zu dem Hauptmetaboliten Salicylsäure umgewandelt[27]. Im Blut geht sie zu 50 bis 70 % eine Bindung an Albumin ein.
Nebenwirkungen und Gegenanzeigen
Die bei analgetischer Dosierung auftretenden Nebenwirkungen sind meist leichterer Art: Übelkeit, Sodbrennen und Erbrechen werden relativ häufig beobachtet. Bei Asthmatikern kann Acetylsalicylsäure Ursache von Anfällen sein, die sich dadurch erklären, dass durch Hemmung der Cyclooxigenasen ein Überangebot an Arachidonsäure vorliegt, die dann die Bildung von bronchokonstriktorischen (die Bronchien verengenden) Leukotrienen begünstigt. Eine Kreuzreaktion zu anderen Schmerzmitteln wie beispielsweise Ibuprofen, Diclofenac oder Naproxen ist häufig.
Die Arzneimittelkommission der deutschen Ärzteschaft weist darauf hin, dass Acetylsalicylsäure aufgrund ihrer Reizwirkung bei regelmäßiger Einnahme Schleimhautreizungen, Blutungen im Magen-Darm-Trakt und Magengeschwüre verursachen kann. Bei chronisch entzündlichen Darmerkrankungen (Morbus Crohn, Colitis ulcerosa) ist Vorsicht geboten, da Acetylsalicylsäure schubauslösend wirken kann.
Bei Kindern und Jugendlichen mit fieberhaften Erkrankungen sollte Acetylsalicylsäure nicht eingesetzt werden, da es (möglicherweise nach einer überstandenen Viruserkrankung) das mitunter tödliche Reye-Syndrom auslösen könnte; es sollte auf alternative Substanzen – wie Paracetamol oder Ibuprofen – ausgewichen werden. In Großbritannien ist die rezeptfreie Abgabe von Acetylsalicylsäure an Kinder und Jugendliche unter 16 Jahren aus diesem Grund verboten. Diskutiert wird auch eine suppressive Wirkung auf das unspezifische Immunsystem, da der Immunmodulator Desoxycholsäure (Literatur) erst nach Abklingen der Wirkungen der Acetylsalicylsäure aktiv werden kann. Dennoch gibt es auch im Kindesalter Krankheitsbilder, bei denen die Behandlung mit Acetylsalicylsäure durchaus angezeigt ist. Dazu gehören das rheumatische Fieber oder das Kawasaki-Syndrom.
In der Schwangerschaft darf Acetylsalicylsäure nur in kleinen Mengen verabreicht werden, da ASS insbesondere im dritten Trimenon zu einem vorzeitigen Verschluss des Ductus arteriosus des ungeborenen Kindes führen kann. Außerdem besteht durch die gehemmte Blutgerinnung eine erhöhte Blutungsneigung der Mutter bei der Geburt.
1999 wurde die Anzahl tödlicher Ereignisse im Zusammenhang mit Aspirin und ähnlichen Schmerzmitteln unter Amerikanern auf jährlich 16.500 geschätzt[28].
Im Jahr 2004 geriet Aspirin in die Schlagzeilen, da in einer großen Studie mit 88.000 Teilnehmerinnen (Nurses' Health Study) ein Zusammenhang zwischen langjähriger und häufiger Aspirineinnahme und Bauchspeicheldrüsenkarzinomen gezeigt wurde. In einer vorhergehenden Studie mit 28.000 Teilnehmerinnen (Iowa Women's Health Study) wurde zuvor jedoch gerade ein gegenteiliger Effekt für Aspirin gezeigt, nämlich dass die regelmäßige Einnahme vor Bauchspeicheldrüsenkrebs schützt. Eine noch größere Studie der American Cancer Society mit insgesamt 987.590 Teilnehmern zeigte dann jedoch, dass Aspirin weder einen fördernden noch einen schützenden Effekt in Bezug auf Bauchspeicheldrüsenkrebs hat. Dies gilt für Frauen wie für Männer.
Eine britische Metaanalyse zeigte 2010 eine deutliche, signifikante Reduktionsminderung für eine Tumorentstehung bei täglicher Einnahme von ASS auf. Dabei wurden die Patientendaten aus 7 Studien (23 535 Patienten, 657 Todesfälle durch Krebs) analysiert und es konnte gezeigt werden, dass eine Langzeiteinnahme (mind. 5 Jahre) von Aspirin zu einer Reduktion der Krebssterbefälle unabhängig von der Dosierung (75mg oder mehr), Geschlecht oder Rauchverhalten führt, wobei sich der Effekt mit zunehmenden Alter der Probanden und Verlängerung der Einnahmedauer verstärkt. Sowohl gastrointestinale (z.B. kolorektales Karzinom oder Speiseröhrenkrebs) als auch nicht-gastrointestinale Karzinome (z.B. Lungenkrebs) führten seltener zum Tod bei Langzeitaspirineinnahme (bis 20 Jahre wurde analysiert). Der Effekt war bei Adenokarzinomen (gastrointestinale und nicht-gastrointestinale) besonders ausgeprägt. Somit würde eine tägliche Aspirineinnahme über 5-10 Jahre unter Berücksichtigung der Nebenwirkungen von ASS zu einer Reduktion der Todesfälle während dieser Zeit um ca. 10% führen.[29]
Bei Asthmatikern beträgt der Anteil der Patienten mit ASS-Intoleranz etwa 8 bis 20 % und bei Patienten mit Nasenpolypen etwa 6 % bis 15 %. Diese Allergie wird als Samter-Trias bezeichnet. Es wird eine genetische (erbliche) Prädisposition vermutet.[30]
Wie eine 2010 veröffentlichte Studie aus der Schweiz aufzeigte, kann die regelmäßige Einnahme von Aspirin nicht nur zu häufigerem Nasenbluten führen; bei den Patienten, die Aspirin zur Prophylaxe von Herzerkrankungen in Dosen von 100 mg und 300 mg täglich einnahmen, verlief Nasenbluten schwerer als bei vergleichbaren Patienten ohne Aspirineinnahme und bedurfte öfter einer chirurgischen Behandlung.[31]
In einer schwedischen Studie mit 58.465 Studienteilnehmern konnte durch Einsatz des Mortalitätsregisters und des im Patientenregister dokumentierten Arzneimittelgebrauchs festgestellt werden, dass der Gebrauch von Aspirin bei diabetischen Patienten ohne kardiovaskuläre Krankheitsanzeichen zu einer erhöhten Mortalität führte. Bei diabetischen Patienten mit kardiovaskulären Krankheitsanzeichen wurde jedoch eine Verminderung der Mortalität unter der Anwendung von Aspirin beobachtet. Die bisherige Praxis der Anwendung von Aspirin auch bei Diabetikern ohne kardiovaskuläre Krankheitszeichen sollte danach revidiert werden, bis weitere Erkenntnisse aus laufenden Studien verfügbar sind.[32]
Im Tierversuch ergaben sich laut Roter Liste Hinweise auf eine mögliche teratogene Wirkung bei chronischer Einnahme von ASS während der Schwangerschaft.
Arzneimittelinteraktionen und Wechselwirkungen
Wegen der Häufigkeit der gleichzeitigen Anwendung von ASS- und Vitamin E-Präparaten wird der möglichen Arzneimittelinteraktion hinsichtlich der Auswirkungen auf das Gerinnungssystem vermehrte Aufmerksamkeit geschenkt und eine gründliche Kontrolle der Gerinnungsparameter empfohlen. Gesundheitliche Aspekte einer möglichen erhöhten Blutungsneigung unter Komedikation mit Tocopherolpräparaten werden seit einiger Zeit in der Literatur diskutiert[33].
Weiterhin mehren sich in letzter Zeit die Hinweise, dass Acetylsalicylsäure und bestimmte andere Schmerzmittel aus der Gruppe der nichtsteroidalen Antiphlogistika bzw. Nichtsteroidale Antirheumatika (NSAIDs), sowie Paracetamol die Wirksamkeit von Impfstoffen herabsetzen können, indem der Körper nach einer Impfung weniger der schützenden Antikörper bildet.[34][35][36][37][38] Letzteres wird darauf zurückgeführt, dass durch Medikamente wie Acetylsalicylsäure die terminale Differenzierung der B-Zellen zu Antikörper-produzierenden Plasmazellen beeinträchtigt wird.[39] Forscher und Ärzte raten daher, einige Zeit vor und nach der Impfung auf entsprechende Medikamente zu verzichten.[40][41][42]
Toxizität
Hohe Dosen, beispielsweise 10 g ASS beim Erwachsenen, können bereits zu einer lebensgefährlichen metabolischen Azidose (Übersäuerung) mit Atemlähmung und Bewusstlosigkeit führen. Außerdem kann das Innenohr geschädigt werden, was sich in einem Hörverlust oder Tinnitus äußert. Auch Nierenschädigungen sind beschrieben worden (Analgetikanephropathie).
Abgelaufene oder nach Essig riechende Präparate sollten nicht mehr verwendet werden. Letztere waren wahrscheinlich großer Wärme und Feuchtigkeit ausgesetzt, wodurch nicht nur die Wirkung beeinträchtigt wird, sondern auch für den Magen toxische phenolische Abbauprodukte durch autokatalytische Zersetzung entstehen.
Nebenwirkungen der Schmerzmittelgruppe um ASS, der Nichtopioid-Analgetika (also zusammen mit Paracetamol, Ibuprofen u. a.) gehören zu den 16 häufigsten Todesursachen in den USA. Da aber die Zahl der Opfer frei verkäuflicher Schmerzmittel in Statistiken nicht einzeln aufgeführt wird, nimmt die Öffentlichkeit die Gefahren v. a. einer gewohnheitsmäßigen oder dauernden Einnahme kaum wahr.
Die Gefahrstoffkennzeichnung mit dem Gefahrensymbol und dem R-Satz gesundheitsschädlich beim Verschlucken beziehen sich auf größere Mengen des Wirkstoffes, wie sie bei dessen Produktion gehandhabt werden, selbstverständlich jedoch nicht auf die Mengen in fertigen Tabletten bei deren Einnahme gemäß Beipackzettel.
Die mittlere letale Dosis (LD50) bei oraler Aufnahme liegt bei Ratten bei 200 mg/kg Körpergewicht.[4]
Fehlindikationen
Als Schmerzmittel zur Unterdrückung von Wundschmerz wie nach chirurgischen Eingriffen oder Verletzungen ist Acetylsalicylsäure ungeeignet, da die gerinnungshemmende Wirkung bis etwa sieben Tage nach der letzten Einnahme anhält und damit Blutungen begünstigt. Wegen der irreversiblen Hemmung der Cyclooxygenase in den Thrombozyten ist auch eine Gabe eines Gegenmittels zur sofortigen Aufhebung der Gerinnungshemmung nicht möglich. Es muss vielmehr abgewartet werden, bis neue, funktionsfähige Thrombozyten vom Körper gebildet werden. Auf diese Weise kann eingenommene Acetylsalicylsäure aufgrund des erhöhten Blutungsrisikos eine geplante medizinische Operation vereiteln. In besonders dringenden Fällen kann die gerinnungshemmende Wirkung der Acetylsalicylsäure durch Gabe von Thrombozyten-Konzentraten teilweise aufgehoben werden.
Einsatzgebiete
Acetylsalicylsäure wird nicht nur als Schmerzmittel, zur Fiebersenkung und als Antirheumatikum eingesetzt, sondern vor allem auch niedrigdosiert zur Hemmung der Thrombozytenaggregation und damit zur Vorbeugung von erneuten Herzinfarkten und Schlaganfällen (Sekundär/Tertiärprophylaxe) bei bekannten arteriosklerotischen Gefäßveränderungen verwendet. ASS wird zusammen mit Clopidogrel auch bei Patienten mit Stents in den Herzkranzgefäßen eingesetzt, um einen Verschluss (Stentthrombose) zu vermeiden. Ebenfalls kommt es als Thrombozytenaggregationshemmer zum Einsatz, wenn beispielsweise bei Vorhofflimmern aus individuellen Gründen keine Antikoagulation mit Phenprocoumon in Frage kommt.
Aufgrund seiner positiven Wirkungen bei Polycythaemia vera wurde Aspirin von der Europäischen Kommission der Status einer orphan drug erteilt. Somit hat die Bayer HealthCare AG die alleinigen Vermarktungsrechte für ein ASS-Präparat zur Behandlung dieser Krankheit.[43]
Resistenzdiskussion
Eine Acetylsalicylsäure-Resistenz unterschiedlicher Ausprägung wurde in einer kleinen Studie festgestellt, wobei wohl auch die Darreichungsform Einfluss nimmt.[44] Aus diesem Grund gibt es eine Kontroverse über die Einführung von Geräten, um Patienten, die einen Gerinnungshemmer benötigen, auf Acetylsalicylsäure-Resistenz testen zu lassen. Schlussfolgerung wäre bei einem positiven Test, einen anderen Gerinnungshemmer (z. B. zur Vorsorge gegen erneute Infarkte) zu verschreiben. Clopidogrel ist dafür ein Kandidat, jedoch ist dieser etwa 100-mal teurer als Acetylsalicylsäure. Aus diesem Grund hat die Pharmaindustrie eine starke Motivation, für die Einführung von Acetylsalicylsäure-Resistenz-Tests zu werben, während Krankenversicherungen und teilweise Ärzte diesbezüglich eher zurückhaltend sind.[45]
Handelsnamen und Darreichungsformen
Acetylsalicylsäure wird als Monopräparat weltweit in über 500 Fertigarzneimitteln in der Darreichungsform von Tabletten, Sublingualtabletten, Filmtabletten, Schmelztabletten, Trinktabletten, Pulver, Granulat, Kautabletten, Kaudragées, Brausetabletten, Retardtabletten, Kapseln, Retardkapseln, Injektionslösungen, Suppositorien und Dragées vermarktet.[46] Nachfolgend einige Beispiele von Handelsnamen:
- Deutschland: Acesal, Alka-Seltzer, Aspirin, Godamed, Herz-ASS, Miniasal, Togal-ASS, ASS ratiopharm
- Schweiz: Alcacyl, Asa-Tabs, Aspégic, Aspirin, Aspro, Kardégic, Tiatral
- Österreich: Acekapton, Aspirin, Aspro Classic, Herz-ASS, Thrombo-ASS, Togal Mono
Neben diesen Monopräparaten sind noch zahlreiche Generika und Kombinationspräparate im Handel, die neben Acetylsalicylsäure auch Vitamin C, Paracetamol, Coffein oder andere Wirkstoffe enthalten.
Literatur
- Karsten Schrör: Acetylsalicylsäure. G. Thieme, Stuttgart, New York 1992, ISBN 3-13-791801-4, 22 Abbildungen, 15 Tabellen.
- Nicolai Kuhnert: Hundert Jahre Aspirin. In: Chemie in unserer Zeit, 1999, 33 (4), S. 213–220; doi:10.1002/ciuz.19990330406.
- Kay Brune, Tobias Egger: Die Entwicklung der antipyretischen Analgetika. In: Pharmazie in unserer Zeit, 2002, 31 (2), S. 133–139; doi:10.1002/1615-1003(200203)31:2<133::AID-PAUZ133>3.0.CO;2-3.
- Andrew T. Chan et al.: Long-term Aspirin Use and Mortality in Women, in: Arch. Intern. Med., 2007, 167, S. 562–572; PMID 17389287.
- Karsten Schrör: Acetylsalicylsäure. 2. vollständig neu überarbeitete und aktualisierte Auflage, 2011, 410 Seiten mit 110 Abbildungen und ca. 50 Tabellen, ISBN 978-3-9806004-9-1 online-Fassung.
Weblinks
- Acetylsalicylsäure. In: DrugBank - detaillierte Daten zu Acetylsalicylsäure (Englisch)
- Synthese von Acetylsalicylsäure (PH Heidelberg)
- biochemische Grundlagen der Aspirin-Wirkung (FIZ Chemie Berlin)
- Interaktive 3D-Struktur der Acetylsalicylsäure mit detaillierten Röntgenstrukturdaten
Einzelnachweise
- ↑ a b c d e f g h Eintrag zu Acetylsalicylsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 11. September 2011 (JavaScript erforderlich).
- ↑ Cornelia Imming in: Römpp Online - Version 3.5, 2009, Georg Thieme Verlag, Stuttgart.
- ↑ Merck Index, 14. Auflage, 2006, ISBN 978-0-911910-00-1.
- ↑ a b Acetylsalicylsäure bei ChemIDplus
- ↑ H. Bekemeier: Salicylamid- und Salicylsäure-Vergiftung bei der Katze im Vergleich mit anderen Tieren. I., in: Arzneimittelforschung, 1955, 5, S. 572–575; PMID 13276287.
- ↑ Markenregister
- ↑ a b c O. Lafont O: „From the willow to aspirin“. Rev Hist Pharm (Paris). 2007 Jul, 55 (354), S. 209-216; PMID 18175528.
- ↑ Zum Vortrag von Dr. Walter Sneader über die Entwicklung der Acetylsalicylsäure (Presseerklärung Bayer AG, 1999) September 1999.
- ↑ Andreas Schuhmann, Bernhard Sorms; AWD.pharma GmbH & Co. KG (Hrsg.): Geschichte des Arneimittelwerkes Dresden. Dresden 2002, S. 31 f.
- ↑ Aspirin als Jahrhundertpharmakon – Die Geschichte des Wirkstoffs ASS (PDF). Abgerufen am 21. Juni 2009.
- ↑ F. von Bruchhausen, S. Ebel, A. W. Frahm, E. Hackenthal: Hagers Handbuch der Pharmazeutischen Praxis. Band 7: Stoffe A–D. 5. Auflage, Birkhäuser/Springer, 1991, ISBN 3-540-52688-9, S. 43–44
- ↑ Bernd Schäfer: Naturstoffe in der chemischen Industrie, Spektrum Akademischer Verlag, 2007, S. 277, ISBN 978-3-8274-1614-8.
- ↑ Paula, Yurkanis, Bruice: Organic Chemistry. 4. Auflage, Prentice-Hall, 2003, ISBN 0-131-41010-5, S. 801.
- ↑ Bernd Schäfer: Naturstoffe in der chemischen Industrie, Spektrum Akademischer Verlag, 2007, S. 277, ISBN 978-3-8274-1614-8.
- ↑ Prof. Blume: Aspirin und Paraccetamol im chemischen Vergleich, Cornelsen-Verlag.
- ↑ K. Hohmann: Organisches Grundpraktikum. Versuch: Nachweis von Salicylsäure, Philipps-Universität Marburg, Script Wintersemester 2007/2008.
- ↑ Nachweis von Carbonsäuren, Estern und Ethern (pdf), Script der Universität des Saarlandes, Wintersemester 2004.
- ↑ H. Kallbacher: Chemisches Praktikum für Mediziner: Synthese eines Arzneimittels Acetylsalicylsäure (ASS, Aspirin), Kurstag 8, Praktikumsscript der Eberhard-Karls-Universität Tübingen.
- ↑ F. v. Bruchhausen, H. Hager: Hagers Handbuch Der Pharmazeutischen Praxis. Band 2 Methoden, S. 124, Springer-Verlag, 1994, ISBN 978-3-540-52688-9.
- ↑ Ramos-Martos N, Aguirre-Gómez F, Molina-Díaz A, Capitán-Vallvey LF.: Application of liquid chromatography to the simultaneous determination of acetylsalicylic acid, caffeine, codeine, paracetamol, pyridoxine, and thiamine in pharmaceutical preparations, in: J AOAC Int., 2001, 84 (3), S. 676–683; PMID 11417630.
- ↑ Franeta JT, Agbaba D, Eric S, Pavkov S, Aleksic M, Vladimirov S.: HPLC assay of acetylsalicylic acid, paracetamol, caffeine and phenobarbital in tablets, in: Farmaco, 2002, 57 (9), S. 709–713; PMID 12385520.
- ↑ Tsikas D, Tewes KS, Gutzki FM, Schwedhelm E, Greipel J, Frölich JC.: Gas chromatographic-tandem mass spectrometric determination of acetylsalicylic acid in human plasma after oral administration of low-dose aspirin and guaimesal, in: J Chromatogr B Biomed Sci Appl., 1998, 709 (1), S. 79–88; PMID 9653928.
- ↑ Melchert HU, Knopf H, Pabel E, Braemer-Hauth M, Du Y.: Co- and multimedication in users of ASA and vitamin E drugs in the Federal Republic of Germany. Results of the Federal Health Surveys 1984-1999, in: Int J Clin Pharmacol Ther., 2001, 39 (11), S. 488–491; PMID 11727969.
- ↑ J. R. Vane: Inhibition of prostaglandin synthesis as a mechanism of action for aspirin-like drugs, in: Nat. New Biol., 1971, 231, S. 232–235; PMID 5284360.
- ↑ Nobelpreis für Medizin oder Physiologie 1982: „Für ihre bahnbrechenden Arbeiten über Prostaglandine und nahe verwandter biologisch aktiver Substanzen.“ Informationen der Nobelstiftung zur Preisverleihung.
- ↑ Kozak, W. et al.: Molecular mechanisms of fever and endogenous antipyresis, in: Ann N Y Acad Sci., 2000, 917, S. 121–134; PMID 11268336.
- ↑ FACHINFORMATION Aspirin.
- ↑ Wolfe MM. et al. (1999) Gastrointestinal Toxicity of Nonsteroidal Antiinflammatory Drugs. N Engl J Med; 340:1888-1899
- ↑ Rothwell PM et al. Effect of daily aspirin on long-term risk of death due to cancer: analysis of individual patient data from randomised trials. Lancet. 2010 Dec 6. PMID 21144578
- ↑ A. May u. a.: Familienuntersuchung bei Patienten mit ASS-Intoleranz und Rhinosinusitis, in: HNO, 48/2000, S. 650–654.
- ↑ Soyka MB, Rufibach K, Huber A, Holzmann D: Is severe epistaxis associated with acetylsalicylic acid intake?. In: The Laryngoscope. 120, Nr. 1, Januar 2010, S. 200–207. doi:10.1002/lary.20695. PMID 19877246.
- ↑ Welin L, Wilhelmsen L, Björnberg A, Odén A.: Aspirin increases mortality in diabetic patients without cardiovascular disease: a Swedish record linkage study, Pharmacoepidemiol Drug Saf., 2009 August 11; PMID 19672841.
- ↑ Co-medication and multimedication in users of acetylsalicylic acid and vitamin E in Germany, Special review in: J.K. Aronson: Side Effects of Drugs Annual 26. Elsevier, Amsterdam, Boston, Heidelberg… (2003), http://books.google.de/books?id=VEVkxrDN4l8C&pg=PA423&dq=Side+Effects+of+drugs+26+Co-Medication&ei=MiCMSubLJ4mGzAS-kO30DQ#v=onepage&q=&f=false.--
- ↑ Bancos S, Bernard MP, Topham DJ, Phipps RP: Ibuprofen and other widely used non-steroidal anti-inflammatory drugs inhibit antibody production in human cells. In: Cell Immunol. 258, Nr. 1, 2009, S. 18-28. PMID 19345936.
- ↑ Blaho, V. A. et al.: Cyclooxygenase-1 orchestrates germinal center formation and antibody class-switch via regulation of IL-17. In: J Immunol. 183, Nr. 9, 2009, S. 5644–5653. PMID 19843949.
- ↑ Prymula, R. et al.: Effect of prophylactic paracetamol administration at time of vaccination on febrile reactions and antibody responses in children: two open-label, randomised controlled trials. In: Lancet. 374, Nr. 9698, 2009, S. 1339–1350. PMID 19837254. (PDF)
- ↑ Common Pain Relievers May Dilute Power of Flu Shots. University of Rochester Medical Center (URMC). Abgerufen am 27. Juli 2011.
- ↑ Schmerzmittel schwächen Impfschutz. Spiegel Online. Abgerufen am 4. Dezember 2009.
- ↑ Bernard MP, Phipp RP: Inhibition of cyclooxygenase-2 impairs the expression of essential plasma cell transcription factors and human B-lymphocyte differentiation. In: Immunology. 129, Nr. 1, 2010, S. 87-96. PMID 20050331.
- ↑ Over-the-Counter Pain Drugs May Affect Vaccine Strength. WXXI. Abgerufen am 27. Juli 2011.
- ↑ Impfeffekt kann durch manche Medikamente deutlich abgeschwächt werden. Lungenärzte im Netz. Abgerufen am 4. Dezember 2009.
- ↑ Effect of Prophylactic Paracetamol Administration at Time of Vaccination on Febrile Reactions and Antibody Responses in Children F1000 Ranking: "Exceptional" and Changes Clinical Practice". Medscape. Abgerufen am 26. Juli 2011.
- ↑ Entscheidung der EU-Kommission vom 29. Juli 2004 über die Ausweisung des Arzneimittels "Acetylsalicylsäure" als Arzneimittel für seltene Leiden gemäß Verordnung (EG) Nr. 141/2000 des Europäischen Parlaments und des Rates; PDF.
- ↑ Studie zur ASS-Resistenz auf neurologyreviews.com.
- ↑ K. Schrör & H.-Ch. Diener: Sekundärprävention bei TIA und Schlaganfall - Clopidogrel oder ASS?, in: CARDIOVASC. 2/2001, S. 8.
- ↑ Pharmavista - Datenbank Internationale Fertigarzneimittel.

Bitte den Hinweis zu Gesundheitsthemen beachten! Kategorien:- ATC-N02
- ATC-B01
- ATC-A01
- Gesundheitsschädlicher Stoff
- Essigsäureester
- Benzolcarbonsäure
- Nichtopioid-Analgetikum
- Arzneistoff
- Bayer AG
Wikimedia Foundation.