- Nickel(II)-sulfat
-
Strukturformel 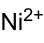
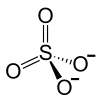
Allgemeines Name Nickel(II)-sulfat Andere Namen Nickelsulfat
Summenformel NiSO4 CAS-Nummer - 7786-81-4 (wasserfrei)
- 10101-97-0 (Hexahydrat)
- 10101-98-1 (Heptahydrat)
Kurzbeschreibung Eigenschaften Molare Masse Aggregatzustand fest
Dichte Schmelzpunkt Siedepunkt thermische Zersetzung: 840 °C [1]
Löslichkeit 650 g·l−1 in Wasser (20 °C)[2]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [3] 


Gefahr
H- und P-Sätze H: 350i-341-360D-372-332-302-315-334-317-410 EUH: keine EUH-Sätze P: 201-280-273-308+313-342+311-302+352 [1] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 

Giftig Umwelt-
gefährlich(T) (N) R- und S-Sätze R: 49-61-20/22-38-42/43-48/23-68-50/53 S: 53-45-60-61 LD50 264 mg·kg−1[2]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Nickel(II)-sulfat ist das Nickelsalz der Schwefelsäure. Es besteht aus je einem Nickel-Kation (Ni2+) und einem Sulfat-Anion (SO42−). Beim Erhitzen über 840 °C tritt Zersetzung unter Bildung von giftigen Dämpfen (Nickelmonoxid, Schwefeltrioxid) auf. In wässriger Lösung bildet Nickel(II)-sulfat schwache Säuren.
Inhaltsverzeichnis
Vorkommen
In der Natur kommt das Heptahydrat des Nickel(II)-sulfats als Mineral Morenosit vor.[4]
Darstellung
Nickel(II)-sulfat kann dargestellt werden durch Reaktion von Nickel mit verdünnter Schwefelsäure und anschließender Kristallisation.
Hydrate
Nickel(II)-sulfat existiert neben der wasserfreien Form auch als Hepta- und Hexahydrat. Das Heptahydrat liegt in Form von dunkelgrünen Kristallen vor. Bei 31,5 °C wird aus dem Heptahydrat Hexahydrat, das smaragdgrün bis blau ist. Die wasserfreie, gelbe Form tritt bei Temperaturen über 103 °C auf.[5]
Verwendung
Nickel(II)-sulfat ist die technisch wichtigste Nickelverbindung. Es dient zur Herstellung von anderen Nickelverbindung und Katalysatoren.[5] Die wässrigen Lösungen von Nickel(II)-sulfat und Nickel(II)-chlorid NiCl2 werden zur galvanischen Abscheidung von metallischen Nickelschichten verwendet. Weiterhin wird es in der Färberei als Beizmittel und bei der Herstellung von Gasmasken verwendet.
Sicherheitshinweise
Nickel(II)-sulfat wurde beim Mensch bekanntermaßen als krebserzeugenden Stoff (Kategorie 1) eingestuft (TRGS 905).[1] Der Stoff kann zu Kontaktallergien führen. Nach dem Verschlucken treten Reizungen des Magen-Darm-Trakts auf.
Einzelnachweise
- ↑ a b c d e f g h Eintrag zu Nickel(II)-sulfat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 4. November 2008 (JavaScript erforderlich)
- ↑ a b Datenblatt Nickel(II)-sulfat bei Merck, abgerufen am 19. Januar 2011.
- ↑ a b Eintrag zu CAS-Nr. 7786-81-4 im European chemical Substances Information System ESIS (ergänzender Eintrag)
- ↑ Handbook of Mineralogy - Morenosite (englisch, PDF 66,4 kB)
- ↑ a b CD Römpp Chemie Lexikon – Version 1.0, Stuttgart/New York: Georg Thieme Verlag 1995
Kategorien:- Krebserzeugender Stoff
- Stoff mit reproduktionstoxischer Wirkung
- Gesundheitsschädlicher Stoff
- Sensibilisierender Stoff
- Umweltgefährlicher Stoff
- Giftiger Stoff
- Nickelverbindung
- Sulfat
Wikimedia Foundation.

