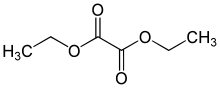
- Oxalate
-
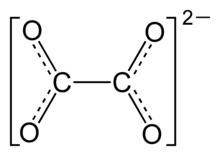 Mesomeriestabilisiertes Oxalat-Anion.
Mesomeriestabilisiertes Oxalat-Anion.
Als Oxalate, nach IUPAC Ethandioate, werden die Salze und Ester der Oxalsäure bezeichnet.
Inhaltsverzeichnis
Salze
Viele salzartige Oxalate sind in Wasser schwer löslich. Am besten in Wasser löslich sind Ammoniumoxalat ((NH4)2(COO)2) und Alkalioxalate, wie Natriumoxalat. Die Fällung des schwerlöslichen Calciumoxalat dient als gängiger Nachweis von Calciumionen. Als Oxalat wird auch das Anion der Oxalsäure genannt.
Da Oxalsäure, aber auch deren Salze, mit Calcium (wird für den Knochenbau benötigt) ein schwer lösliches Salz bildet, kann dieses dann nur langsam ausgeschieden werden. Daher sollte Oxalsäure und deren Salze nur in geringen Dosen konsumiert werden. Oxalsäure ist auch in Schokolade, Spinatblättern und Rhabarber vorhanden.
Analytik
Nachweisverfahren für Oxalate
Die Oxalat-Lösung wird mit Essigsäure/Acetat-Puffer gepuffert, der pH-Bereich liegt zwischen 4 und 6, dann Calciumchlorid-Lösung zugegeben, als Ergebnis entsteht ein weißer Niederschlag von Calciumoxalat (in rhombischer Kristallform). Da ein weißer Niederschlag auch durch andere Ionen gebildet wird, filtriert man den Niederschlag ab und löst ihn in verdünnter Schwefelsäure, tropft einen Tropfen Kaliumpermanganatlösung dazu und erwärmt die Probe. Durch das Erwärmen muss sich die durch Kaliumpermanganat gefärbte Lösung entfärben.
Quantitative Bestimmung
In wässriger Lösung kann die Konzentration der Oxalat-Ionen durch Titration mit KMnO4-Lösung bestimmt werden, jedoch muss man die Oxalatlösung vorher auf 70 °C erwärmen. Bei der Titration läuft folgende Reaktion ab:
Ester
Die Ester der Oxalsäure, auch Oxalsäureester genannt, haben die allgemeine Formel R1O-CO-CO-OR2, wobei R Alkyl- oder Arylreste sind. Saure Ester mit nur einem organischen Rest sind nicht stabil, können aber als stabile Salze vorliegen. Die neutral regierenden, zweifachen Ester werden als Lösemittel verwendet. Wichtige Ester sind Oxalsäuredimethylester und Oxalsäurediethylester.
Vorkommen
Vorkommen in Pflanzen
Oxalate kommen in den meisten Pflanzen vor. Sie sind das Produkt des unvollständigen Abbuas von Kohlenhydraten.
Bekannte Pflanzen mit einem sehr hohen Anteil an Oxalaten sind der Weißer Gänsefuß und der Wiesen-Sauerampfer. Auch die Wurzeln und Blätter des Rhabarbers und des Buchweizens enthalten seht hohe Konzentationen an Oxalat-Ionen.[1]
Andere essbare Pflanzen mit signifikanten Mengen an Oxalat sind die Sternfrucht, Schwarzer Pfeffer, Petersilie, Mohnsamen, Amarant, Spinat, Mangold, Rote Beete, Heidelbeeren und die meisten Nüsse. Auch Kakao enthält beträchliche Mengen an Oxalaten. Die Blätter des Teestrauches (Camellia sinensis) nehmen beim Oxalatgehalt einen Spitzenplatz ein. Es ist allerdings zu berücksichtigen, ein Tee dieser Blätter nur einen vergleichsweise geringe Konzentration aufweist. Dies liegt zum einen an der geringen Menge an Teeblättern, die für die Zubereitung benötigt wird, zum anderen daran, dass viele Oxalate nur mäßig in Wasser löslich sind.
Vorkommen in Mineralien
Oxalate kommen in wenigen, seltenen Mineralien vor. Die Systematik der Mineralien nach Strunz gibt hierzu einen Überblick: Salze von organischen Säuren. Auch wenn es sich bei den natürlich als Mineralien vorkommenden Oxalaten (z.B. Whewellit) um die Salze einer organischen Säure handelt, so müssen bei der Bildung nicht zwangsweise biologischen Prozesse beteiligt gewesen sein.
Physiologische Effekte
Im Körper von höheren Organismen bilden die Oxalatanionen mit zweiwertigen Metallionen wie Calcium (Ca2+) und zweiwertigen Eisen (Fe2+) bei der Ausscheidung über die Nieren kleine Kristalle. Durch weitere Aggregation können sich hieraus größere Nierensteine bilden. Etwa 80% aller Nierensteine bestehen aus Calciumoxalat. [2] Neben weiteren Nierenkrankheiten können Oxalate auch für Gicht, Rheumatoide Arthritis und Vulvodynie) ursächlich sein.
Cadmium katalysiert die Umwandlung von Vitamin C in die Oxalsäure. Dies kann bei Menschen, die hohen Cadmiumbelastungen ausgesetzt sind, z.B. Rauchern, zu Problemen führen.
Einzelnachweise
- ↑ Streitweiser, Andrew Jr.; Heathcock, Clayton H.: Introduction to Organic Chemistry, Macmillan 1976, S. 737
- ↑ Coe FL, Evan A, Worcester E.: Kidney stone disease. In: J Clin Invest.. 115, Nr. 10, 2005, S. 2598–608. doi:10.1172/JCI26662. PMID 16200192. Volltext bei PMC: 1236703.
Weblinks
 Wikisource: Ueber einige oxalsaure Doppelsalze – Quellen und Volltexte
Wikisource: Ueber einige oxalsaure Doppelsalze – Quellen und Volltexte
Wikimedia Foundation.