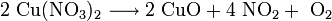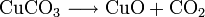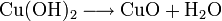- Oxidschicht
-
 Korund-Stücke bestehen wie Saphire aus farblosen, harten Aluminiumoxid-Kristallen und eingeschlossenen, farbgebenden Spuren
Korund-Stücke bestehen wie Saphire aus farblosen, harten Aluminiumoxid-Kristallen und eingeschlossenen, farbgebenden SpurenEin Oxid (von griech. ὀξύς, oxýs = scharf, spitz, sauer) ist eine Sauerstoff-Verbindung in der dieser die Oxidationszahl −II hat. Die meisten Oxide entstehen, wenn brennbare Stoffe mit Sauerstoff reagieren (Ursprung des Wortes Oxidation): Bei ihrer Oxidation geben sie Elektronen an das Oxidationsmittel Sauerstoff ab, so dass Oxide gebildet werden.
Je nach Bindungspartner unterscheidet man in der Chemie zwei Stoffgruppen von Oxiden:
- Nichtmetalloxide (diese sind molekular, i.a. leicht flüchtig und reagieren mit Wasser zu Säuren) und
- Metalloxide (diese sind ionische (salzartige) oder kovalente Oxide; Oxide unedler Metalle reagieren mit Wasser zu Basen und bilden Laugen).
Der überwiegende Teil der Erdkruste und des Erdmantels besteht aus Oxiden (vor allem aus Siliciumdioxid (Quarz) und hiervon abgeleiteten Salzen, den Silikaten sowie Aluminiumoxid). Auch Wasser gehört zur Stoffgruppe der Oxide.
Inhaltsverzeichnis
Herstellung
Oxide werden hergestellt durch:
- Reaktion von Elementen mit Sauerstoff (Oxidation im engeren Sinne, früher auch als Oxygenierung bezeichnet),
- Erhitzen von Hydroxiden und Oxidhydraten (Beispiel: Kupfer(II)-hydroxid wird zu Kupfer(II)-oxid und Wasserdampf, Rost wird zu Eisenoxiden und Wasserdampf),
- Erhitzen von Salzen mit flüchtigen Anhydriden (Beispiel: Das Brennen von Kalk / Calciumcarbonat zu Calciumoxid, Erhitzen von Kupfer(II)-nitrat zu Kupfer(II)-oxid und nitrosen Gasen)
Das oben abgebildete schwarze Kupfer(II)-oxid kann also z. B. durch folgende Reaktionen synthetisiert werden:
Ferner ließe sich das rote Kupfer(I)-oxid durch Sauerstoff in schwarzes Kupfer(II)-oxid umwandeln. Auch beim Rösten sulfidischer Kupfererze wird Kupfer(II)-oxid hergestellt, indem man Kupfer(II)-sulfid an Luft oder im Sauerstoffstrom glüht (Nebenprodukt Schwefeldioxid).
Eigenschaften der Oxide
Es gibt saure, basische und amphotere Oxide.
- Nichtmetalloxide sind molekular und reagieren mit Wasser zu Säuren,
- Metalloxide sind salzartig (ionisch); Oxide unedler Metalle reagieren mit Wasser zu Basen und Laugen).
- Amphotere Oxide und Hydroxide haben die Eigenschaft, sauer UND basisch reagieren zu können - je nach Reaktionspartner (vgl. unter Säure-Base-Reaktion): Sie reagieren mit Säuren UND mit Basen zu Salzen.
Oxide edlerer Metalle werden zwecks Reaktion mit Wasser daher oft über einen Umweg als Salze in Hydroxide verwandelt: Kupfer(II)-oxid kann z. B. in konz. Salzsäure zu Kupfer(II)-chlorid gelöst werden. Dieses bildet mit Natronlauge Kupfer(II)-hydroxid, welches wie oben angegeben durch Erhitzen in Kupfer(II)-oxid umgewandelt werden kann.
Hydroxide sind flockige Niederschläge, die oft charakteristische Färbungen aufweisen (Kupfer(II)-hydroxid hellblau, Nickel(II)-hydroxid apfelgrün, Chrom(III)-hydroxid graugrün, Mangan(II)-hydroxid rosa und an Luft in Folge von Oxidation braun werdend, Cobalt(II)-hydroxid blau oder rosa, Eisen(III)-hydroxid rostbraun, Eisen(II)-hydroxid graugrün).
Oxid-Ion und Hydroxid-Ion
Das den Metalloxiden zugrunde liegende O2−-Ion entsteht bei der Redoxreaktion des Oxidationsmittels Sauerstoff mit einem Metall. Es ist nur in Schmelzen und in Kombination mit Kationen (in Form von Salzen) existent, nicht jedoch als freies Ion, denn es ist eine extrem starke Base und wird somit in wässriger Lösung quantitativ zum Hydroxid-Ion protoniert (Säure-Base-Reaktion). Metall-Hydroxide enthalten das OH−-Ion und werden meistens aus Salzlösungen und Laugen gewonnen.
In Nichtmetalloxiden liegt in der Regel kein Oxid-Anion vor, da Nichtmetalle untereinander eine kovalente Atombindung eingehen. Das dem Oxidion ähnelnde Peroxidion weist eine Oxidationszahl von -I statt -II auf, da hier zwei Sauerstoffatome miteinander verbunden sind. Nichtmetalloxide reagieren mit Wasser zu Säuren (mit Oxo-Anionen wie Sulfat, Carbonat usw.). Sie sind somit als Hydroxide von saurem Charakter anzusehen.
Das Bindungsvermögen des Sauerstoffs
Sauerstoff ist ein starkes Oxidationsmittel und bildet mit fast allen Elementen isolierbare Oxide, mit Ausnahme der Edelgase Helium, Neon, Argon, Krypton und des Halogens Fluor (Fluor nimmt hierbei eine Sonderstellung ein, weil zwar die Sauerstoffverbindungen OF2, O2F2 und O4F2 darstellbar sind, diese Stoffe aber wegen der höheren Elektronegativität des Fluors nicht als Fluoroxide, sondern als Sauerstofffluoride bezeichnet werden).
Sauerstoff bildet neben Oxiden auch Oxo-Anionen: Hier haben sich mehrere Sauerstoffatome an ein Atom gebunden, welches zumeist die höchstmögliche Oxidationszahl aufweist (Beispiele: Phosphat, Sulfat, Chromat, Permanganat, Nitrat, Carbonat). Sie entstehen in der Regel, wenn Nichtmetall- und Nebengruppenmetall-Oxide mit sehr hoher Oxidationszahl mit Wasser zu Säuren reagieren.
Zudem existieren Sauerstoff-Sauerstoff-Verbindungen wie z. B. im Bleichmittel Wasserstoffperoxid (s.o.). Anorganische Peroxide sind stark ätzend und oxidierend, organische Peroxide in der Regel explosiv.
Einzelne Oxide und weitere Sauerstoff-Verbindungen
Bekannte Oxide sind, in alphabetischer Reihenfolge:
- Aluminiumoxid (ein weißer, leicht basischer Feststoff)
- Bleioxid (hier gibt es ein gelbes und ein schwarzbraunes Oxid sowie ein Mischoxid, Mennige genannt)
- Calciumoxid (Gebrannter Kalk, ätzend, stark basisch)
- Eisenoxide wie Eisen(III)-oxid oder Rost
- Kohlenstoffdioxid (bildet mit Wasser Kohlensäure)
- Kohlenstoffmonoxid (toxisch, farb- und geruchlos, brennbar)
- Kupferoxid (hier gibt es rotes Kupfer(I)-oxid und schwarzes Kupfer(II)-oxid)
- Magnesiumoxid (Magnesia, ein weißes, basisches Pulver)
- Phosphorpentoxid (bildet mit Wasser Phosphorsäure)
- Schwefeldioxid (säuerlicher Geruch, mit saurer Reaktion in Wasser löslich)
- Schwefeltrioxid (bildet mit Wasser Schwefelsäure)
- Siliciumdioxid (Quarz, bildet mit Wasser u. U. Kieselsäure)
- Stickoxide (zumeist braun gefärbt durch Stickstoffdioxid, kann u. U. weiterreagieren zu Salpetersäure)
- Wasserstoffoxid (Wasser)
- Zinkoxid (ein erdig-weißes, in Hitze hellgelbes Pulver)
Sauerstoffverbindungen mit Sauerstoff in anderen Oxidationsstufen sind :
- Peroxide (−1),
- Hyperoxide (−½),
- Ozonide (−1/3) und
- Salze mit dem Dioxygenyl-Kation O2+ (+½).
Siehe auch
Wikimedia Foundation.

-oxid.jpg)