- Plutonium(III)-fluorid
-
Kristallstruktur 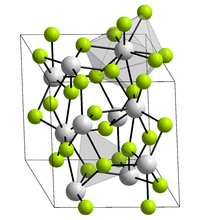
__ Pu3+ __ F− Kristallsystem Raumgruppe 
Gitterkonstanten Koordinationszahlen Pu[9], F[3]
Allgemeines Name Plutonium(III)-fluorid Andere Namen Plutoniumtrifluorid
Verhältnisformel PuF3 CAS-Nummer 13842-83-6 PubChem 139624 Kurzbeschreibung violette Kristalle[1]
Eigenschaften Molare Masse 301,06 g·mol−1 Aggregatzustand fest
Dichte 9,3 g·cm−3[2]
Schmelzpunkt Siedepunkt 1957 °C[1]
Sicherheitshinweise EU-Gefahrstoffkennzeichnung [3] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Radioaktivität 
RadioaktivThermodynamische Eigenschaften ΔHf0 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Plutonium(III)-fluorid ist eine chemische Verbindung bestehend aus den Elementen Plutonium und Fluor. Es besitzt die Formel PuF3 und gehört zur Stoffklasse der Fluoride.
Inhaltsverzeichnis
Darstellung
Plutonium(III)-fluorid ist schwerlöslich und entsteht durch die Umsetzung einer wässrigen Plutonium(III)-nitratlösung mit Fluoridsalzen im Sauren.[4]
Eigenschaften
Plutonium(III)-fluorid bildet violette Kristalle mit einem Schmelzpunkt von 1396 °C.[1] Es kristallisiert in der Lanthanfluoridstruktur mit den Gitterparametern a = 709,3 pm und c = 725,4 pm.[1] Hierbei ist jeder Plutoniumkern von neun Fluorkernen in einer verzerrten dreifach-überkappten trigonal-prismatischen Struktur umgeben. Es ist sublimierbar und hat eine größere Flüchtigkeit als Americium(III)-fluorid.[5][6]
Verwendung
Um Plutonium zur Wiederaufbereitung durch Ausfällung aus Lösungen abtrennen zu können, wurde eine Methode zur Ausfällung als Plutonium(III)-fluorid entwickelt, um eine Alternative zur bisherigen Plutoniumperoxidmethode zu haben.[7] Eine Studie des Los Alamos National Laboratory aus dem Jahr 1957 berichtet, dass diese Methode gegenüber dem bisherigen Verfahren weniger effektiv sei,[8] während eine neuere Studie, die vom US-Office of Scientific and Technical Information in Auftrag gegeben wurde, diese als eine eher effektivere Methode darstellt.[9][10]
Sicherheitshinweise
Einstufungen nach der Gefahrstoffverordnung liegen nicht vor, obwohl die chemische Giftigkeit bekannt ist. Wichtig sind die auf der Radioaktivität beruhenden Gefahren, sofern es sich um eine dafür relevante Stoffmenge handelt.
Einzelnachweise
- ↑ a b c d e f g Gmelins Handbuch der anorganischen Chemie, System Nr. 71, Transurane, Teil C, S. 101–104.
- ↑ Plutonium(III)-fluorid bei www.webelements.com.
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ G. A. Burney, F. W. Tober: "Precipitation of Plutonium Trifluoride", in: Ind. Eng. Chem. Process Des. Dev., 1965, 4 (1), S. 28–32; doi:10.1021/i260013a009.
- ↑ Stephen C. Carniglia, B. B. Cunningham: „Vapor Pressures of Americium Trifluoride and Plutonium Trifluoride, Heats and Free Energies of Sublimation“, in: J. Am. Chem. Soc., 1955, 77 (6), S. 1451–1453; doi:10.1021/ja01611a015.
- ↑ P. D. Kleinschmidt: „Sublimation Studies of Plutonium Trifluoride“, in: Journal of Nuclear Materials, 1989, 167, S. 131–134; doi:10.1016/0022-3115(89)90434-0.
- ↑ C. K. Gupta: Hydrometallurgy in Extraction Processes, 2, S. 206–208, CRC Press 1990, ISBN 0-8493-6805-7 (Zugriff am 20. Juni 2008).
- ↑ R. S. Winchester: Aqueous Decontamination of Plutonium from Fission Product Elements, S. 9–10, Los Alamos Scientific Laboratory of the University of California 1957 (Zugriff am 20. Juni 2008).
- ↑ L. L. Martella: Laboratory-scale evaluations of alternative plutonium precipitation methods. United States Office of Scientific and Technical Information (Zugriff am 20. Juni 2008).
- ↑ K. F. Grebenkin, Yu. N. Zuev, L. N. Lokhtin, N. A. Novoselov, A. V. Panov, V. A. Simonenko, V. G. Subbotin, V. M. Berezkin, E. N. Zvonarev, O. I. Kozlov, V. I. Lobanov, V. P. Mashirev, V. V. Shatalov, A. D. Maksimov, D. Yu. Chuvilin: „Synthesis of Plutonium Trifluoride from Weapons – Plutonium as a Potential Fuel for Power Reactors“, in: Atomic Energy, 1997, 83 (2), S. 614–621; doi:10.1007/BF02413891.
Literatur
- David L. Clark, Siegfried S. Hecker, Gordon D. Jarvinen, Mary P. Neu: Plutonium, in: Lester R. Morss, Norman M. Edelstein, Jean Fuger (Hrsg.): The Chemistry of the Actinide and Transactinide Elements, Springer, Dordrecht 2006; ISBN 1-4020-3555-1, S. 813–1264; doi:10.1007/1-4020-3598-5_7.
Weblinks
Wikimedia Foundation.

