- Rolling-Circle-Replikation
-
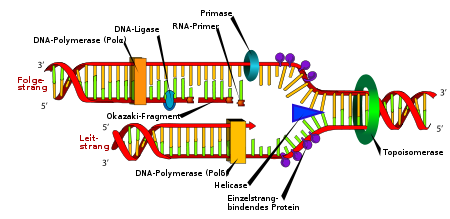 DNA-Replikation. Die Doppelhelix wird durch die Helicase und die Topoisomerase geöffnet. Danach setzt die Primase einen Primer und die DNA-Polymerase beginnt, den Leitstrang zu kopieren. Eine zweite DNA Polymerase bindet den Folgestrang, kann aber nicht kontinuierlich synthetisieren, sondern produziert einzelne Okazaki-Fragmente, welche von der DNA-Ligase zusammengefügt werden.
DNA-Replikation. Die Doppelhelix wird durch die Helicase und die Topoisomerase geöffnet. Danach setzt die Primase einen Primer und die DNA-Polymerase beginnt, den Leitstrang zu kopieren. Eine zweite DNA Polymerase bindet den Folgestrang, kann aber nicht kontinuierlich synthetisieren, sondern produziert einzelne Okazaki-Fragmente, welche von der DNA-Ligase zusammengefügt werden.Die Replikation oder Reduplikation beschreibt die Vervielfältigung des Erbinformationsträgers DNA einer Zelle nach einem semi-konservativen (von lateinisch semi „halb“; conservare „erhalten“) Prinzip. Dabei handelt es sich in der Regel um eine exakte Verdoppelung der DNA. Die Replikation wird in der Regel nur in einer bestimmten Phase des Zellzyklus angestoßen: Bei den Eukaryoten während der Synthese-Phase, auch S-Phase vor der Mitose, also vor einer Zellteilung. Da die genetische Verdoppelung zusammen mit der zellulären Verdopplung die Vermehrung der Prokaryoten, also aller Bakterien und Archaeen darstellt, ist die Replikation mit der Zellteilung stark gekoppelt.
Die Vervielfältigung erfolgt semikonservativ, das heißt, der ursprüngliche DNA-Doppelstrang wird in seine Einzelstränge getrennt, an denen dann jeweils komplementäre Stränge neu gebildet werden. „Komplementär“ bedeutet, dass ein einzelner DNA-Strang die Basen-Abfolge (Sequenz) des gegenüberliegenden Stranges eindeutig bestimmt, denn jede Base eines DNA-Nucleotids kann nur mit einem festgelegten Partner über Wasserstoffbrückenbindungen eine stabile Beziehung eingehen (Adenin - Thymin und Guanin - Cytosin; vgl. auch Basenpaar).
Die Replikation kann dabei nach verschiedenen Mechanismen ablaufen, von denen folgende bekannt sind:
- Die Vervielfältigung des Kerngenoms der eukaryotischen Zellen sowie des Bakteriengenoms findet „bidirektional“ statt, daher erfolgt die Replikation vom Startpunkt ausgehend (die Startsequenz liegt meist inmitten des Strangs, nicht am Anfang) in beide Richtungen, an beiden Muttersträngen gleichzeitig. Das bidirektionale Prinzip ist das am häufigsten vertretene Prinzip in der Natur.
- Die Vervielfältigung nach dem „rolling-circle-Prinzip“. Es tritt vor allem bei der Konjugation auf, bei der ein Bakterium einen Einzelstrang eines Plasmid an ein anderes weitergibt.
- Die „asymmetrische Replikation“ der DNA der Mitochondrien (mtDNA), auch „D-Loop“ genannt, bei der die Replikation an den Muttersträngen nicht gleichzeitig, sondern zeitversetzt erfolgt.
Der Ablauf der Replikation lässt sich in vier Phasen unterteilen:
- Die Initiationsphase, in der die Replikation angestoßen wird: Hier wird die DNA-Doppelhelix an einer bestimmten Stelle mit Hilfe der Helicase aufgebrochen und eine Polymerase lagert sich nach der Markierung durch eine Primase an die aufgebrochene DNA.
- Die Elongationsphase, in der die eigentliche Vervielfältigung vonstatten geht: Die beiden Stränge werden zeitgleich komplementär synthetisiert.
- Die Interphase, in der die Stränge komplementär angeordnet und zusammengefügt werden.
- Die Terminationsphase, in der die Replikation beendet wird.
Inhaltsverzeichnis
Die allgemeine Replikation nach dem semikonservativen Prinzip
Die Replikation nach dem semikonservativen Prinzip wurde schon von Watson und Crick postuliert, da sie aus der DNA-Doppelstrang-Konstruktion der Erbinformation ableitbar ist. Neben zwei anderen Prinzipien (konservatives und dispersives Prinzip) wurde das semikonservative durch den Meselson-Stahl-Versuch belegt. Das Grundprinzip sagt aus, dass der Original-Doppelstrang geöffnet wird und beide Teilstränge als Vorlage für die Replikation dienen. Dabei wird der replizierte Strang wieder entsprechend der Watson-Crick-Basenpaarung gebildet. Die Replikation nach dem semikonservativen Prinzip stellt den allgemein gelehrten Replikationsmechanismus dar. Alle anderen Prinzipien sind Sonderfälle, die jeweils nur zum Teil bewiesen sind.
Da alle Bakterien sowie der Zellkern aller Eukaryoten doppelsträngige DNA enthalten, kommt dieser Replikationsmechanismus in der Natur auch am häufigsten vor. Ausnahmen bilden hier einige Mitochondrien, bei denen ein anderer Mechanismus abläuft, sowie Plasmid- und Virengenome, bei denen die Erbinformation auch als DNA-Einzelstrang vorliegen kann. Hier muss ein gänzlich anderer Mechanismus gefunden werden. Bei Retroviren, deren Erbinformation stets in Form eines RNA-Doppel- oder -Einzelstrangs vorliegt, wird die Replikation von der Wirtszelle übernommen, indem die RNA durch eine Reverse Transkriptase in DNA umgeschrieben und in das Wirtsgenom eingebaut wird.
Replikation bei den Prokaryoten
Initiation
In der Zelle liegt die helikale DNA nicht geordnet ringförmig oder linear vor, sondern ist zusätzlich in sich verdrillt (sog. „supercoils“, DNA-Doppelhelix). Um repliziert werden zu können, muss sie entwunden werden. Die Folge der Entwindung der DNA an einer Stelle ist die zunehmende Verdrillung des gesamten DNA-Doppelstranges. Um Torsionsspannungen bei der Entwindung entgegenzuwirken, läuft vor jeder Replikationsgabel eine Topoisomerase, die die Verdrillung vermindern kann (Entspannungsreaktion). Dazu ist die Spaltung der DNA-Stränge notwendig. Je nach Enzymtyp werden kontrolliert Einzel- oder Doppelstrangbrüche durchgeführt. Nach der Entwindung werden die zuvor gespaltenen Phosphorsäureesterbindungen des Zucker-Phosphat-Gerüsts der DNA durch das Enzym wieder geknüpft.
Für die Initiation der Replikation ist ein spezieller Ort, der Replikationsursprung auf der meist ringförmigen DNA notwendig, der den Startpunkt bestimmt. Dieser wird bei Prokaryoten als Origin (Ursprung) bezeichnet und ist bei Escherichia coli gut aufgeklärt. An dieser Stelle werden die Wasserstoffbrückenbindungen zwischen den Basen der beiden Einzelstränge aufgetrennt.
Der sogenannte oriC umfasst 250 Basenpaare (bp) mit verschiedenen funktionalen Elementen. Zunächst wird das Initiatorprotein DnaA durch ATP aktiviert und an fünf 9 bp lange DnaA-Boxen gebunden. Insgesamt lagern sich etwa 20 DnaA-Proteine als Schleife um die DNA zusammen. Die Proteine IHF und FIS binden an spezifische Abschnitte des oriC und lösen die Beugung der DNA zu einer haarnadelähnlichen Struktur aus, welche auch die Bindung von DnaA unterstützt. Schließlich kann die Entwindung der Doppelhelix an drei aufeinanderfolgenden, 13 bp langen Adenin- und Thymin-reichen Sequenzen (auch „13mer Sequenzen“ genannt) starten.
Dieser Vorgang wird von einer Helicase unter ATP-Verbrauch katalysiert. Bei E. coli heißt diese DnaB und wird durch das Protein DnaC zum Origin geleitet. Durch die Auftrennung des Doppelstranges entstehen so am Origin zwei Replikationsgabeln, die während der Replikation bidirektional auseinanderlaufen. Damit sich die Basen nicht wieder über Wasserstoffbrückenbindungen paaren, halten sogenannte Einzelstrang-bindende Proteine (bei den Prokaryoten heißt dies „SSB-Protein“ für engl. „single-strand-binding-protein“) die einzelnen Stränge auseinander.
Im Anschluss der Öffnung folgt das Priming: An den nun freien Einzelsträngen wird durch eine RNA-Polymerase, die Primase, ein kurzes RNA-Stück, der Primer (unter zellulären Bedingungen etwa 10 Nukleotide) gesetzt. Dieser Komplex wird als Primosom bezeichnet und ist notwendig, da der Hauptproteinkomplex der Replikation, die DNA-Polymerase mit der Synthese des jeweils zweiten Stranges DNA nur an einer freien 3'-OH-Gruppe beginnen kann. Das heißt: Die DNA-Polymerase benötigt den Primer als „Starthilfe“ für die Replikation, auch wenn es sich dabei um RNA handelt. Die für den Primer eingesetzte RNA-Polymerase benötigt nur den Einzelstrang als Matrize. Hat die DNA-Polymerase dann aber erst mit der Synthese des zweiten Stranges (von 5' nach 3') begonnen, kann sie kaum unterbrochen werden und arbeitet bis zur Termination fort. Somit muss die Regulation der Replikation in der Initiationsphase geschehen.
Elongation
Nach der Initiation und der nun beginnenden Polymerisierung wird die Elongationsphase durchlaufen. Hier synthetisiert die DNA-Polymerase die komplementären Stränge zu den Einzelsträngen: Die Basen der Einzelstränge werden nacheinander abgelesen und, nach dem Prinzip der Basenpaarung, im synthetisierten Strang entsprechend nacheinander eingebaut. Für die DNA-Synthese notwendige Bausteine liegen in Form der freien Nukleotide in der Zelle vor. Dabei ergibt sich jedoch ein Problem: Die DNA-Polymerase kann nur in 5'-3'-Richtung synthetisieren. Da nun aber der DNA-Polymerasekomplex an beiden Strängen gleichzeitig synthetisiert, beide Stränge aber gemäß der doppelhelikalen Struktur entgegengesetzt orientiert sind, ergeben sich zwei gegenläufige (auch antiparallele) Stränge an der Replikationsgabel. Man unterscheidet hierbei zwischen dem Leitstrang (auch Vorwärts-Strang oder kontinuierlicher Strang, engl. „leading strand“), der von der Replikationsgabel aus gesehen in 5'-3'-Richtung orientiert ist, und dem Folgestrang (auch Rückwärts-Strang oder diskontinuierlicher Strang, engl. „lagging strand“) (ebenfalls 5´-3´Richtung, allerdings auf dem anderen Strang!). Es ist zu beachten, dass die neu synthetisierten DNA-Stränge, in jeweilig entgegengesetzter Orientierung wie ihre Matrizenstränge vorliegen.
Am Leitstrang kann nach einmaligem Priming bis zur Symmetrieachse der Replikationsgabel durchgehend repliziert werden, da dieser genau mit der Leserichtung des Polymerasekomplexes und in Laufrichtung der Replikationsgabel orientiert ist. Am Folgestrang ist eine kontinuierliche Replikation hingegen nicht möglich, da er in die „falsche Richtung“ verläuft. Dabei läuft die Polymerase bei dem ersten Lauf gegen den Primer des Leitstranges der zweiten Replikationsgabel, die in die andere Richtung verläuft. Nach der Unterbrechung muss ein erneutes Priming auf dem Folgestrang erfolgen, damit die Polymerase wieder erneut ansetzen kann. Dieses Priming erfolgt immer direkt der Helicase folgend. In den folgenden unregelmäßigen Polymerasezyklen am Folgestrang beendet die Polymerase die Synthetisierung immer am letzten RNA-Primer, also am 5'-Ende des vorhergehenden Fragments. Die so entstehenden DNA-Einzelfragmente werden auch als Okazaki-Fragmente bezeichnet.
Da der Polymerasekomplex nur in eine Richtung, nämlich hinter der Helicase her, verläuft, muss der Folgestrang entsprechend ausgerichtet werden. Es gibt einige gut belegte Hinweise darauf, dass der Bereich zwischen Primase und dem letzten Okazaki-Fragment als eine Schleife verdreht wird, so dass die Polymerase beide Stränge mit gleicher Laufrichtung bearbeiten kann. Ist die Synthese der Schleife beendet, wird diese wieder aufgelöst und eine neue Schleife gebildet. Hier scheint wieder eine Topoisomerase mitzuwirken.
Da die Verdoppelung an einem Strang kontinuierlich, am anderen mit Unterbrechungen verläuft, spricht man auch von einer semidiskontinuierlichen Verdoppelung.
Damit nun ein kontinuierlicher Strang entsteht, der keine RNA-Stücke enthält, tritt noch während der Replikation ein weiterer Mechanismus in Aktion: Eine RNase H entfernt die RNA-Primer und eine weitere DNA-Polymerase (bei Prokaryoten und Eukaryoten ist dies die DNA-Polymerase I) füllt die entstandene Lücke mit der jeweils komplementären DNA.Die DNA-Ligase schließt dann die Bindung vom 3'-Ende des neuen zum 5'-Ende des alten DNA-Stückes, stellt also zwischen den neu synthetisierten DNA-Strängen die Phosphodiesterbindungen her.
Termination
Bei den Prokaryoten mit einer ringförmig aufgebauten DNA sind gegenüber dem Origin gelegene Terminationssequenzen gefunden worden. Dabei handelt es sich genauer um zwei Sequenzen, jeweils eine für eine Replikationsgabel. Normalerweise muss die Termination nicht besonders ausgelöst werden, da, wenn zwei Replikationsgabeln aufeinanderlaufen bzw. die DNA, wie bei einer linearen Form, endet, die Replikation damit automatisch beendet wird. Es handelt sich hierbei um ein Kontrollelement, damit die Replikation bei verschiedenen Replikationsgeschwindigkeiten beider Replikationsgabeln kontrolliert an einem bestimmten Punkt endet. Die Terminationsstellen sind Bindeorte für das Protein Tus (terminus utilizing substance). Dieses blockiert die replikative Helikase (DnaB) und bringt damit die Replikation zum Stillstand. Die replizierten ringförmigen Stränge bleiben bei Prokaryoten nach der Replikation noch für eine Weile miteinander verbunden, genau an dieser terminalen Stelle, damit sie nach der Zellteilung von weiteren Prozessen abschließend getrennt und aufgeteilt werden können. Ohne diese Verbindung scheint eine Kontrolle bei der Verteilung nicht vorhanden zu sein. Die Trennung der DNA-Ringe kann über zwei Mechanismen erfolgen wobei entweder eine TypI- oder eine TypII-Topoisomerase beteiligt ist.
Replikation bei den Eukaryoten
Die Replikation läuft bei Eukaryoten im Wesentlichen identisch ab. Allerdings gibt es einige Ausnahmen und Sonderfälle. So muss berücksichtigt werden, dass die DNA stärker „verpackt“ ist (z. B. beim Heterochromatin), die DNA-bindenden Proteine (die Histon- und Nicht-Histon-Proteine) stärkeren Einfluss haben und die DNA in linearer Form vorliegt. Zudem handelt es sich bei den beteiligten Proteinen in der Regel um solche mit gleicher Funktionalität, aber unterschiedlichem Aufbau.
Einer der wesentlichen Unterschiede liegt in der Initiation: Bei den Eukaryoten gibt es mehrere Origins. Der Vorteil dessen ist leicht ersichtlich, da zum Einen die Replikation durch die mehr vorhandenen DNA-bindenden Proteine langsamer verläuft, zum Anderen die eukaryotische Polymerase, die einen komplexeren Reparaturmechanismus als bei Prokaryoten besitzt (sogenanntes „proofreading“), langsamer fortschreitet. Die Polymerase schafft bei Eukaryoten ca. 50 bis 100 Nukleotide pro Sekunde, während bei Prokaryoten mehr als 1000 Nukleotide pro Sekunde ergänzt werden können. Des Weiteren ist die eukaryotische DNA in der Regel wesentlich größer als die der Prokaryoten (wenige Milliarden Basenpaare bei Eukaryoten gegenüber einigen Millionen bei Prokaryoten). Mehrere Origins und damit mehrere Replikationseinheiten verkürzen die Zeit, die benötigt wird, das gesamte Genom zu replizieren, auch wenn die Geschwindigkeit von Prokaryoten nicht erreicht wird (Die Replikationszeit der Prokaryoten liegt im Bereich von einigen Minuten, bei Eukaryoten beträgt sie mehrere Stunden).
Die Origins der Eukaryoten haben keine spezielle Sequenz, vielmehr handelt es sich wohl dabei um eine sogenannte Consensus-Sequenz, also eine Ähnlichkeitssequenz. Diese werden auch ARS-Elemente genannt. Andere Befunde gehen davon aus, dass große Bereiche der DNA, sogenannte Replikationszentren, als mögliche Startpunkte für die Replikation dienen können. Die, wie auch immer, als Origin erkannten Stellen werden durch einen Origin-Erkennungskomplex (ORC, origin recognition complex), einen Cdc6-Protein und sogenannte MCM-Proteine (minichromosome maintenance protein) markiert. Diese später wieder entfernten Proteine bilden quasi die Vorhut zur Replikation.
Der weitere Initiationsverlauf sowie die Elongation ist mit dem der Prokaryoten funktional identisch.
Terminale Sequenzen wurden bisher bei den Eukaryoten nicht entdeckt. Sie scheinen auch keine Bedeutung zu haben, da der Replikationsapparat automatisch beendet wird, sobald das Ende der DNA erreicht wird. Hierbei ergibt sich aber, im Gegensatz zur ringförmigen DNA-Struktur der Prokaryoten, ein Problem: Die DNA-Polymerase synthetisiert am Mutterstrang jeweils von 3' nach 5'. (Der Tochterstrang hat also die Ausrichtung 5'-3') Die Polymerase benötigt aber eine Primase als Starthilfe um DNA duplizieren zu können. Die Primase ist ein Enzym, welches eine kurze Startsequenz der DNA als RNA repliziert. Dieses Anfangsstück präsentiert der DNA-Polymerase ein Nukleotid mit einem freien 3'-OH-Ende, an welches es weiter DNA-Nukleotide synthetisieren werden können. Nach erfolgreicher Synthese werden die RNA-Primer von Enzymen zerstört und hinterlassen so Lücken. An den Telomeren, den Enden der Chromosomen, können diese Lücken aber nicht geschlossen werden, da kein vorhergehendes 3'-Ende vorhanden ist. Ganz ähnlich entstehen die Okazaki-Fragmente bei der Synthese des Verzögerungsstrangs. Hierbei muss die Polymerase nämlich in die verkehrte Richtung arbeiten, weshalb viele Primasen verwendet werden müssen. Die dabei entstehenden Lücken können aber mit DNA-Ligasen verbunden werden. Dies ist möglich, da hier immer ein vorhergehendes Nukleotid mit einem 3'-Ende vorhanden ist. Da an den Telomeren keine solche Nukleotide vorhanden sind, ist die vollständige Synthese der Enden nicht möglich. So verkürzen sich bei jeder Chromosomenverdopplung die Telomere am 5'-Ende beider Töchterstränge. Da Telomere aus einer tandemartig-repetitiven Sequenz, also einer hintereinander sich wiederholenden Sequenz aufgebaut sind, die keine Strukturgene beinhaltet, ist ein Verlust bis zu einer gewissen Länge nicht von großem Nachteil. Man vermutet aber, dass die DNA mit zunehmender Replikationsanzahl instabiler wird, da die stabilisierende Wirkung der Telomere immer schwächer wird. Eventuell könnte dies ein genetisches Indiz für das Altern sein.
Bei Keimbahnzellen und Stammzellen sowie auch bei einigen Tumorzellen hat man ein Enzym namens Telomerase entdeckt, welches diesen Verlust kompensiert. Dies ist eine Reverse Transkriptase, eine RNA-abhängige DNA-Polymerase, in ihr liegt die repetitive Sequenz als Matrize vor. Sie verlängert den Leitstrang um einige Sequenzen, so dass die DNA-Polymerase nach erfolgtem Priming den Folgestrang synthetisieren kann.
An den Zentromeren ist der heterochromatische Anteil so hoch, dass hier die Replikation bis zur Metaphase der Mitose nicht abgeschlossen ist, wodurch die Schwesterchromatiden bis dahin zusammen bleiben. Erst im Übergang zur Anaphase wird die Replikation wirklich vollständig abgeschlossen.
Die allgemeine Replikation nach dem rolling-circle-Prinzip
Bei Viren und bei Plasmiden tritt ein anderes Replikationsprinzip auf: Handelt es sich um ringförmige Doppelstrang-DNA, wird ein Strang durch eine Endonuclease aufgebrochen, das heißt, hier wird die Verbindung zwischen zwei nebeneinanderliegenden Basen auf einem Strang unterbrochen. An dieser Bruchstelle setzt sich nun ebenfalls ein DNA-Polymerasekomplex an, der aber nur in eine Richtung arbeitet. Das 3'-OH-Ende des geschnittenen Strangs dient dabei als Ansatzpunkt (sog. „Primer“). An der Bruchstelle des aufgebrochenen Stranges wird weiterpolymerisiert, dieser Strang wird also verlängert. Dabei dient der nicht aufgebrochene komplementäre Strang als Matrize. Da die Replikationseinheit dadurch um den inneren Strang herumwandert wie um einen rollenden Kreis, spricht man von dem rolling-circle-Prinzip. Im Gegensatz zu den anderen Prinzipien existieren bei diesem Typ der Replikation auch Polymeraseeinheiten, die in 3'-5'-Richtung synthetisieren.
Der innere Strang kann mehrmals als Matrize dienen, sodass mehrere Duplikate hintereinander synthetisiert werden können. Diese werden nach dem ersten Replikationsschritt nacheinander zerlegt und als Matrize für den zweiten Schritt verwendet, aus dem die replizierten doppelsträngigen DNA hervorgehen.
Liegt die DNA als Einzelstrang vor, wird die DNA vorher in eine Doppelstrang-DNA umgebaut.
Das rolling-circle-Prinzip scheint in der Natur in verschiedenen Formen zu existieren. Der genaue Verlauf ist bisher nicht aufgeklärt. Der beschriebene Ablauf stellt die verbreitetste Hypothese dar.
Die allgemeine Replikation nach dem asymmetrischen Prinzip
Die Replikation mitochondrialer und plastider DNA besitzt einen Unterschied im Ablauf: Die Polymerase repliziert verzögert, sie beginnt mit der Replikation an einem Strang und erst wenn der schon replizierte Strang mehr als zwei Drittel der ursprünglichen DNA verdrängt hat, löst sie sich komplett und der gelöste Strang wird unabhängig repliziert. die Polymerase repliziert dabei ebenfalls in nur eine Richtung.
Dieses Prinzip wird auch D-Loop oder Verdrängungsschleife genannt.
Weblinks
- David Hull und John S. Wilkins: Eintrag in der Stanford Encyclopedia of Philosophy (englisch, inklusive Literaturangaben)
- Maxanim animierte Darstellung der DNA-Replikation (engl.)
- Replikation der DNA – Kurze Erläuterung des Ablaufs
- Replikation der DNA mit Bildern und Beschreibung
- Animierte Darstellung der DNA-Replikation mit Erläuterungen
Wikimedia Foundation.
