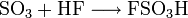- Schwefelsäurefluorid
-
Strukturformel 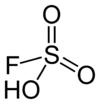
Allgemeines Name Fluorsulfonsäure Andere Namen - Fluorschwefelsäure
- Schwefelsäurefluorid
- Schwefelsäuremonofluorid
Summenformel FHO3S CAS-Nummer 7789-21-1 Kurzbeschreibung farblose Flüssigkeit Eigenschaften Molare Masse 100,06 g·mol–1 Aggregatzustand flüssig
Dichte 1,74 g·cm–3 (15 °C)[1]
Schmelzpunkt Siedepunkt 162,6 °C[1]
Dampfdruck Löslichkeit löslich in Wasser, Ether und Alkohol
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 
Ätzend (C) R- und S-Sätze R: 20-35 S: (1/2)-26-45 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Fluorsulfonsäure ist eine farblose Flüssigkeit und eine der stärksten kommerziell verfügbaren Säuren. Sie ist auch unter dem Namen Fluorschwefelsäure bekannt. Das Molekül ist mit der Formel FSO2OH besser beschrieben, weil es die Verbindung zur Schwefelsäure (H2SO4) genauer ausdrückt. FHO3S ist ein tetraedrisches Molekül.
Inhaltsverzeichnis
Gewinnung und Darstellung
Fluorsulfonsäure wird hergestellt durch die Reaktion von Fluorwasserstoff und Schwefeltrioxid:
Alternativ, kann KHF2 oder CaF2 bei 250 °C mit Dischwefelsäure behandelt werden. Einmal befreit von Flusssäure durch Spülung mit einem Inertgas kann FSO3H in einem Glasgefäß destilliert werden.
Chemische Eigenschaften
Fluorsulfonsäure ist löslich in polaren organischen Lösungsmitteln (z.B. Nitrobenzen, Diethylether, Essigsäure und Ethylacetat), aber schlecht löslich in unpolaren Lösungsmittel wie Alkanen. Durch ihre große Stärke löst sie fast alle organischen Verbindungen auf, die auch nur schwache Protonenakzeptoren sind. FSO3H hydrolysiert langsam zu Flusssäure und Schwefelsäure. Die mit ihr in Verbindung stehende Trifluormethansulfonsäure CF3SO3H behält die hohe Säurestärke von FSO3H ist aber hydrolytisch stabil.
FSO3H ist eine der stärksten bekannten einfachen Brønsted-Säuren, obgleich aktuelle Arbeiten über Carboran-Säuren zu stärkeren Säuren geführt haben. Es hat einen H0 Wert von −15, verglichen mit −12 für Schwefelsäure. Die Kombination von FSO3H und der Lewis-Säure Antimon(V)-fluorid produziert "magische Säure", die ein weit stärkeres protonenlösendes Mittel ist. Diese Säuren fallen alle in die Kategorie von "Supersäuren" (Säuren, die stärker sind als 100%ige Schwefelsäure).
Verwendung
Fluorsulfonsäure wird zur chemische Synthese von Fluorverbindungen, in der Glasindustrie und als Katalysator für chemische Synthesen verwendet. Es isomerisiert Alkane und die Alkylierung der Kohlenwasserstoffe mit Alkenen. Es kann auch als Fluorierungsmittel verwendet werden.
Sicherheitshinweise
Fluorsulfonsäure ist hochgiftig und ätzend. Sie hydrolisiert unter Abgabe von Flusssäure. Die Zugabe von Wasser zu FSO3H ist ähnlich gefährlich, wie die Zugabe von Wasser zu Konz. Schwefelsäure.
Quellen
- ↑ a b c d Eintrag zu CAS-Nr. 7789-21-1 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 18,8,2007 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 7789-21-1 im European chemical Substances Information System ESIS
Wikimedia Foundation.