- Sodium Lauryl Sulfate
-
Strukturformel 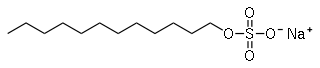
Allgemeines Name Natriumlaurylsulfat Andere Namen - SDS
- Natriumdodecylsulfat
- Dodecylsulfat-Natriumsalz
- Schwefelsäuredodecylester-Natriumsalz
Summenformel C12H25NaO4S CAS-Nummer 151-21-3 Kurzbeschreibung fest, farblos, geruchlos [1] Eigenschaften Molare Masse 288,4 g·mol−1 Aggregatzustand fest
Dichte 1,1 g·cm–3 (20 °C) [2]
Schmelzpunkt Siedepunkt 380 °C (Thermische Zersetzung) [1]
Löslichkeit gut löslich in Wasser (250 g·l−1 bei 20 °C) [2]
Sicherheitshinweise Gefahrstoffkennzeichnung [2] 

Leicht-
entzündlichGesundheits-
schädlich(F) (Xn) R- und S-Sätze R: 11-21/22-36/37/38 S: 26-36/37 WGK 2 – wassergefährdend [2] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Natriumlaurylsulfat oder Natriumdodecylsulfat (Abkürzung: SLS aus dem engl. Sodium Lauryl Sulfate, SDS aus dem engl. Sodium Dodecyl Sulfate) ist ein Monoester der Schwefelsäure, bestehend aus einer langkettigen (C12) Alkylgruppe und einem modifizierten Sulfatanion mit einem Natriumkation. Es ist ein anionisches Tensid, das als Detergens Verwendung findet.
Inhaltsverzeichnis
Gewinnung und Darstellung
SDS kann durch Veresterung von Dodecanol mit Schwefelsäure, Chlorsulfonsäure oder Schwefeltrioxid und nachfolgender Neutralisation gewonnen werden. Ebenso ist die Addition von Schwefelsäure an 1-Dodecen möglich.
Eigenschaften
SDS wird als allergieauslösend und hautreizend betrachtet, weswegen seine Verwendung in Kosmetika umstritten ist. Insbesondere wird von Menschen mit spezieller Empfindlichkeit die Verursachung von Aphthen im Mundraum durch SDS-haltige Zahnpasten beobachtet. Allerdings weist SDS eine antibakterielle und antivirale Wirkung auf. Inwiefern es in der Lage ist, HI-Viren zu zerstören, wie geltend gemacht wurde[3], bleibt zu klären.
Verwendung
SDS dient in den meisten Shampoos und Duschgelen als reinigende Komponente. Darüber hinaus wird SDS als Emulgator in Salben und Lotionen sowie Reinigungsmitteln verwendet.
Die intensive Anwendung als Denaturierungsmittel für Proteine ist ein Grund für die Bedeutung von SDS in höheren Konzentrationen für die Biotechnologie. Die Wirkung auf Proteine basiert darauf, dass nichtkovalente Bindungen der Proteine unterbrochen und so deren Quartär- und Tertiärstruktur zerstört werden. Dabei bindet SDS im Verhältnis von ca. 1,4/1 g. Durch die Eigenschaft, Mizellen auszubilden, sind SDS-Protein-Lösungen nicht dialysierbar; eine Entfernung von SDS ist durch Fällungsreaktionen mit organischen Lösungsmitteln möglich (siehe Henderson, 1979).
In der Analytik wird SDS bei der Polyacrylamid-Gelelektrophorese (SDS-PAGE) verwendet.[4]
Nachweis
Siehe auch
Literatur
- L. E. Henderson, S. Oroszlan, W. Konigsberg: A Micromethod for Complete Removal of Dodecyl Sulfate from Proteins by Ion-Pair Extraction. Analytical Biochemistry 93, 153–157, 1979.
- U. K. Laemmli: Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature 227, 680–5, 1970.
Quellen
- ↑ a b Sicherheitsdatenblatt Merck
- ↑ a b c d e Eintrag zu Natriumdodecylsulfat in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 17. Januar 2008 (JavaScript erforderlich)
- ↑ planetark.org
- ↑ U. K. Laemmli: Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature 227, 680–5, 1970
Weblinks
Wikimedia Foundation.
