- Chlorsulfonsäure
-
Strukturformel 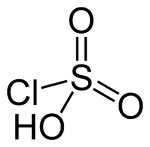
Allgemeines Name Chlorsulfonsäure Andere Namen - Chlor(o)schwefelsäure
- Schwefelsäurechlorhydrin
- Sulfurylhydroxylchlorid
Summenformel HSO3Cl CAS-Nummer 7790-94-5 PubChem 24638 Kurzbeschreibung farblose, stechend riechende, hygroskopische Flüssigkeit[1]
Eigenschaften Molare Masse 116,53 g·mol−1 Aggregatzustand flüssig
Dichte 1,75 g·cm−3 (20 °C)[1]
Schmelzpunkt Siedepunkt 152 °C (unter Zersetzung)[1]
Dampfdruck Löslichkeit heftige Zersetzung in Wasser[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [2] 

Gefahr
H- und P-Sätze H: 314-335 EUH: 014 P: 261-280-305+351+338-310 [3] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 
Ätzend (C) R- und S-Sätze R: 14-35-37 S: (1/2)-45-26 LD50 50 mg·kg−1 (Ratte, peroral)[4]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Chlorsulfonsäure oder Chloroschwefelsäure (HSO3Cl) ist ein unvollständiges Säurechlorid der Schwefelsäure, in dem nur eine Hydroxygruppe der Schwefelsäure durch Chlor ersetzt ist. Chlorsulfonsäure ist eine farblose, stechend riechende und an der Luft stark rauchende Flüssigkeit. Der Schmelzpunkt liegt bei −80 °C, der Siedepunkt bei 152 °C. Chlorsulfonsäure ist wie alle Säurechloride sehr reaktionsfähig, mit Wasser reagiert sie heftig unter Umsetzung zu Schwefelsäure und Salzsäure.
Ihre Wirkung als Nebelmittel beruht auf der Reaktion mit der Luftfeuchte, wobei sich ein Nebel aus Schwefelsäure und Salzsäure bildet. Dieser saure Nebel ist sehr aggressiv, er greift Metalle an und reizt zum Husten, ebenso werden organische Stoffe (Holz, Gewebe) angegriffen. Wird zusätzlich Schwefeltrioxid in Chlorsulfonsäure gelöst, erhält man die Nebelsäure, die noch dichtere Nebel als Chlorsulfonsäure bildet. Der Einsatz von Chlorsulfonsäure als Nebelmittel setzt eine ausreichend hohe Luftfeuchte voraus, daher wurde Chlorsulfonsäure vorrangig bei der Marine eingesetzt. Zum einen wegen der Feuchte, und zum anderen, weil das Schiff sich vom entstehenden Nebel entfernen kann und somit dessen aggressiver Wirkung weniger ausgesetzt ist.
Chlorsulfonsäure wird außer als Nebelmittel bei der Herstellung von chemischen Zwischenprodukten (Einführung der HSO3-Gruppe in aromatische Verbindungen) sowie zur Herstellung von Ionenaustauschern benutzt.
Synthese
Chlorsulfonsäure kann durch Einwirken von Phosphorpentachlorid auf konz. Schwefelsäure dargestellt werden:[5]
Technisch wird Chlorsulfonsäure dargestellt, indem man Chlorwasserstoffgas in flüssiges Schwefeltrioxid einleitet:[6]
Einzelnachweise
- ↑ a b c d e f Eintrag zu Chlorsulfonsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 4. Januar 2008 (JavaScript erforderlich).
- ↑ a b Eintrag zu CAS-Nr. 7790-94-5 im European chemical Substances Information System ESIS (ergänzender Eintrag)
- ↑ Datenblatt Chlorosulfonic acid bei Sigma-Aldrich, abgerufen am 22. März 2011.
- ↑ Datenblatt Chlorsulfonsäure bei Merck, abgerufen am 19. Januar 2011.
- ↑ Nils Wiberg, Egon Wiberg und Arnold Fr. Holleman: Lehrbuch der Anorganischen Chemie. de Gruyter; stark umgearbeitete und verbesserte 102. Auflage 2007; ISBN 3-11-017770-6; S. 591.
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 385-6.
Wikimedia Foundation.



