- NBr3
-
Strukturformel 
Allgemeines Name Stickstofftribromid Andere Namen Tribromamin
Summenformel NBr3 CAS-Nummer 15162-90-0 Kurzbeschreibung dunkelroter, explosiver Feststoff[1] Eigenschaften Molare Masse 253,72 g·mol−1 Aggregatzustand fest
Schmelzpunkt explodiert > −100 °C[2]
Sicherheitshinweise Gefahrstoffkennzeichnung [3] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Stickstofftribromid ist eine chemische Verbindung, die zur Gruppe der Stickstoffhalogenide gehört. Durch ihre Empfindlichkeit und hohe Explosivität gibt es keine praktische Anwendung für die Verbindung.
Inhaltsverzeichnis
Vorkommen
Wird bei der Desinfektion von Schwimmbäder anstelle von Chlor Brom eingesetzt, kann durch die Reaktion mit Harnstoff aus menschlichen Ausscheidungen als Nebenprodukt Stickstofftribromid[4][5] entstehen.
Gewinnung und Darstellung
Stickstofftribromid lässt sich gewinnen durch Bromierung von Stickstofftrichlorid[6]
oder durch Umsetzung von Ammoniumbromid, Natriumchlorit und Eisen(III)-bromid
oder durch Reaktion von Bis-trimethylsilylbromamin mit Bromchlorid[7] bei –85 °C in n-Pentan als Lösungsmittel
Auch durch Elektrolyse einer Ammoniumiodid und Kaliumbromid Lösung (NH4I + KBr) kann Stickstofftribromid hergestellt werden.
Literatur
- Jochen Jander: Non-Aqueous Solvents for Preparation and Reactions of Nitrogen Halogen Compounds. Pure & Appi. Chem., Vol. 49, S. 67–73
Quellen
- ↑ webelements.com
- ↑ Arnold F. Holleman, Nils Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage, de Gruyter, Berlin 2007. ISBN 978-3-11-017770-1.
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ LennTech:Bromine as Desinfectant
- ↑ Water Quality and Health Council:Pool Helath
- ↑ Lateral Science: Fulminating oils
- ↑ Jochen Jander: Non-Aqueous Solvents for Preparation and Reactions of Nitrogen Halogen Compounds. Pure & Appi. Chem., Vol. 49, S. 67–73
Wikimedia Foundation.

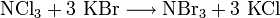
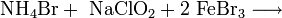
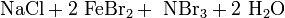
![\mathrm{[(CH_3)_3Si]_2NBr + 2 \ BrCl \longrightarrow NBr_3 + 2 \ (CH_3)_3SiCl}](/pictures/dewiki/99/cf1507969ac1f5231b33045ddaa0a386.png)