- TTSS
-
Das Typ-III-Sekretionssystem (engl. Type III secretion system; als TTSS oder T3SS abgekürzt) ist eine Proteinstruktur (manchmal als Organell betrachtet), die in manchen Gram-negativen Bakterien auftritt.
Diese Struktur dient zur Sekretion bakterieller Proteine in eukaryotische Zellen. Diese Proteine ermöglichen es den Bakterien, die eukaryotischen Zellen (die Wirte) zu infizieren. Die Proteine werden direkt von der bakteriellen Zelle in die Wirtszelle mittels eine Nadelstruktur, dem Kennzeichen des T3SS, übertragen.
Inhaltsverzeichnis
Überblick
Der Begriff „Typ-III-Sekretionssystem“ wurde 1993 erstmals verwendet. [1]. Dieses Sekretionssystem unterscheidet sich von mindestens fünf anderen bakteriellen Sekretionssystemen. Das T3SS tritt nur in Gram-negativen, meist pathogenen, Bakterien auf. Schätzungsweise besitzen 25 Bakterienarten das System. Die am besten erforschten T3SS sind aus Arten von Shigella (verursacht Bakterienruhr), Salmonella (Typhus), Escherichia coli (Enteritis, Colitis), Burkholderia (Rotz), Yersinia (Pest) und Pseudomonas (infiziert Menschen, Tiere und Pflanzen) bekannt.
Das T3SS besteht in jeder Bakterienart aus ungefähr 30 verschiedenen Proteinen. Damit ist es eines der komplexesten Sekretionssysteme. Seine Struktur ist derjenigen von Flagellen sehr ähnlich. Diese sind lange, extrazelluläre Organelle, die der Bewegung des Bakteriums dienen. Manche Proteine, die am T3SS beteiligt sind, haben ähnliche Aminosäurensequenzen wie Flagellenproteine. Ein Teil der T3SS besitzenden Bakterien hat auch Flagellen und ist beweglich (Salmonella, z. B.). Andere haben keine Flagellen und sind unbeweglich (Shigella, z. B.). In der Tat wird die Typ-III-Sekretion für die Aussetzung sowohl von Infektionsproteine als auch Flagellenproteine eingesetzt. Der Begriff „Typ-III-Sekretion“ wird jedoch hauptsächlich zur Bezeichnung des Infektionsapparats benutzt. Es wird darüber debattiert, ob T3SS und Flagellen evolutionär verwandt sind.
Das T3SS ist für die Pathogenität des Bakteriums notwendig. Defekte im T3SS bedeuten oft den Verlust der Infektionsfähigkeit. Krankheiten, die die oben genannten T3SS-Bakterien verursachen, infizieren Millionen von Menschen und töten Hundertausende jedes Jahr, hauptsächlich in Ländern der dritten Welt. Traditionelle Antibiotika waren in der Vergangenheit effizient gegen diese Bakterien, aber resistente Stämme tauchen immer wieder auf. Die Aufklärung des Mechanismus des T3SS und die Entwicklung spezifischer Medikamente sind seit den späteren 1990er-Jahren zu einem wichtigen Ziel vieler Forschungsgruppen weltweit geworden.
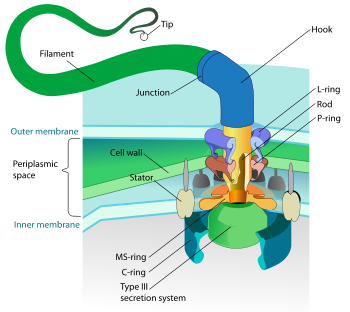
Struktur [2] [3]
Das Kennzeichen der T3SS ist die Nadel (genereller als Nadelkomplex bekannt; wird auch Injectisom genannt). Zu sekretierende Proteine werden durch die Nadel vom bakteriellen Zytoplasma zum Zytoplasma der Wirtszelle direkt übertragen. Die zwei Zytoplasmen werden durch drei Membranen getrennt: die Doppelmembran des Gram-negativen Bakteriums und die eukaronytische Membran. Die Nadel ermöglicht einen glatten Durchgang durch diese hochselektiven und nahezu undurchlässigen Membranen. Ein einzelnes Bakterium besitzt in der Regel mehrere hunderte Nadelkomplexe, die in seiner Membran verteilt sind.
Der Nadelkomplex beginnt im Zytoplasma des Bakteriums, geht durch die zwei Membrane und ragt aus der Zelle heraus. Der membrangebundene Teil ist die Basis des T3SS. Der extrazelluläre Teil ist die Nadel. Ein sogenannter innerer Stab (engl. inner rod) verbindet Nadel und Basis. Die Nadel selbst, obwohl der größte und herausragendste Teil des Komplexes, besteht aus mehreren Untereinheiten eines einzigen Proteins. Die Mehrheit der verschiedenen T3S-Proteine besteht daher aus diesen, die die Basis bilden und die sekretiert werden. Wie oben erwähnt, ist der Nadelkomplex dem bakteriellen Flagellum sehr ähnlich. Genauer betrachtet ist die Nadelbasis der Flagellenbasis sehr ähnlich. Die Nadel selbst ist dem Flagellenhaken analog, eine Struktur, die das Flagellenfilament mit der Basis verbindet.
Die Basis besteht aus mehreren kreisförmigen Ringen und ist die erste Struktur, die beim Herstellen einer neuen Nadel aufgebaut wird. Wenn die Basis fertig ist, dient sie als Sekretionsmaschine für die äußeren Proteine (d. h. die Nadel). Wenn der ganze Komplex fertig ist, findet ein sogenannter Spezifizitätswechsel statt: Das System hört auf, Nadelproteine zu sekretieren und fängt an (bei Bedarf), Proteine zu sekretieren, die in Wirtszellen gelangen sollen. Es wird vermutet, dass die Nadel von unten nach oben aufgebaut wird. Nadeluntereinheiten häufen sich aufeinander, so dass die Untereinheit an der Spitze als allerletzte hinzugefügt wird. Die Nadeluntereinheit ist eines der kleinsten T3SS-Proteine, mit einem Gewicht von 9 kDa. Jede Nadel besteht aus etwa 100 bis 150 Untereinheiten.
Die T3SS-Nadel ist ungefähr 60−80 nm lang und (von außen) 8 nm breit. Eine bestimmte Minimumlänge ist nötig, damit andere extrazelluläre Strukture des Bakteriums (wie Adhesin und Lipopolysaccharide, z. B.) die Sekretion nicht stören. Der hohle Rohr innerhalb der Nadel ist nur 3 nm breit. Das bedeutet, dass die sekretierten Proteine ungefalten sein müssen, wenn sie die Nadel passieren. Gefalten wären die meisten Effektoren für die Nadel zu groß.
T3S-Proteine
T3S-Proteine lassen sich in drei Gruppen einordnen:
- Strukturelle Proteine: bilden die Basis, den inneren Stab und die Nadel.
- Effektoren: werden in Wirtszellen sekretiert und unterstützen die Infektion.
- Chaperone: binden Effektoren im bakteriellen Zytoplasma an, schützen diese vor Abbau und Aggregation (Biologie) und leiten sie in Richtung Nadelkomplex.
Die meisten T3SS-Proteine gehören zu Operonen. Diese Operonen befinden sich bei manchen Arten auf dem bakteriellen Chromosom und bei anderen auf einem eigenen Plasmid. Salmonella, zum Beispiel, hat eine Region auf dem Chromosom, die sogenannte Salmonella-Pathogenitätsinsel (SPI), in der fast alle T3SS-Gene zu finden sind. Shigella hingegen besitzt ein großes Virulenzplasmid, auf dem sich alle T3SS-Gene befinden.
Zu sekretierende Effektorproteine müssen vom System anerkannt werden, denn sie befinden sich im Zytoplasma zusammen mit Tausenden anderer Proteine. Fast alle Effektore tragen ein Sekretionsignal—eine kurze Aminosäurensequenz, normalerweise am Anfang (N-Terminus) des Proteins, die der Nadelkomplex erkennen kann.
Induktion der Sekretion
Kontakt der Nadel mit einer Wirtszelle löst Sekretion aus. Nicht viel ist über den Auslösermechanismus bekannt (siehe unten). Nicht nur Wirtszellen können die Sekretion induzieren. Die Sekretion lässt sich durch die Erniedrigung der Konzentration der Kalziumionen im Nährmedium induzieren (bei Yersinia und Psudomonas; das wird durch Hinzufügen von Chelatoren wie EDTA oder EGTA erreicht). Der aromatische Farbstoff Congo Red induziert die Sekretion bei Shigella. Mit diesen und anderen Methoden wird in Forschungslaboren Typ-III-Sekretion künstlich induziert.
Induktion von Sekretion durch externe Signale außer Kontakt mit Wirtszellen findet auch in vivo statt, in infizierten Organismen. Die Bakterien empfinden Signale wie Temperatur, pH, Osmolarität und Sauerstoffkonzentration, und benutzen diese, um über den richtigen Zeitpunkt für die Sekretion zu „entscheiden“. Zum Beispiel, Cholesterin, ein Lipid, welches sich in fast allen eukaryotischen Zellmembranen befindet, induziert Sekretion in Shigella. Die Ionen Format und Acetat induzieren Sekretion in Salmonella. Diese Ionen sind im Krummdarm zu finden, die Hauptstelle für Salmonella-Infektionen.
Die oben genannten Signale regulieren die Sekretion entweder direkt oder durch genetische Mechanismen. Einige T3S-Transkriptionsfaktoren sind bekannt. Ein Teil der T3S-Chaperone dient auch als Transkriptionsfaktoren. Dies geschieht durch einen Rückkopplungsmechanismus. Zu Zeiten in denen keine Sekretion stattfindet, sind die Chaperone an den Effektoren im Zytoplasma gebunden. Bei Sekretion trennen sich Chaperone und Effektore. Die letzteren werden sekretiert und die ersteren wirken dann als Transkriptionsfaktoren. Sie binden an Genen, die für ihre jeweiligen Effektore codieren und induzieren ihre Transkription und dadurch die Herstellung weiterer Effektore.
T3SS-vermittelte Infektion
T3SS-Effektoren dringen in den Nadelkomplex an der Basis ein und gelangen durch die Nadel in Richtung Wirtszelle. Wie genau die Effektoren in die Wirtszelle eindringen, ist meist unbekannt. Früher wurde vorgeschlagen, dass die Nadel selbst Löcher in der Wirtsmembran bewirken kann; dies wurde aber später widerlegt. Man weiß jetzt, dass einige Effektoren, gemeinsam Translokatoren genannt, zuerst sekretiert werden und eine Pore oder einen Kanal (ein Translokon) in der Wirtsmembran erzeugen. Durch die Pore können die restlichen Effektore die Wirtszelle eintreten. Mutierte Bakterien, in den die Translokatoren fehlen, können zwar Effektore sekretieren, können aber diese nicht in die Wirtszelle liefern und sind daher nicht pathogen. In der Regel hat jedes T3SS drei Translokatoren. Manche Translokatoren haben eine Doppelrolle. Nach der Entstehung der Pore treten sie die Zelle ein und dienen dort als „echte“ Effektoren.
Ungelöste Themen
Hunderte von Artikeln über T3SS wurden seit Mitte der 1990er-Jahre veröffentlicht. Trotzdem bleiben viele Fragen offen:
- T3SS-Proteine. Weniger als ein Drittel der ungefähr 30 T3SS-Proteinen wurden in jedem Organismus biochemisch nachgewiesen. Die anderen, vielleicht selteneren Proteine, erwiesen sich als schwer detektierbar, obwohl genetische eher als biochemische Untersuchungen wurden auf zahlreichen T3SS-Proteinen durchgeführt. Auch die Lokalisierung jedes Proteins ist nicht völlig aufgeklärt.
- Länge der Nadel. Es ist nicht bekannt, wie das Bakterium es „weiß“, wenn eine neue Nadel eine angemessene Länge erreicht hat. Es existieren einige Theorien, unter anderen das Bestehen eines „Maßstabproteins“, welches die Spitze der Nadel mit der Basis verbindet. Wenn neue Nadelunterheiten an der Spitze hinzugefügt werden, streckt sich das Maßstabprotein und „meldet“ damit der Basis die Länge der Nadel.
- Energetik. Mit welcher Kraft die Proteine durch die Nadel nach außen getrieben werden ist nicht völlig bekannt. Eine ATPase ist an der Basis des Nadelkomplexes gebunden und nimmt am Leiten von Proteinen in Richtung Nadel teil. Ob sie die Energie für den Transport liefert, ist unklar.
- Sekretionssignal. Wie oben erwähnt, besitzen Effektorproteine ein Sekretionssignal, das dem Sekretionssystem hilft, diese Effektoren von anderen Proteinen zu unterscheiden. Die Voraussetzungen und der genaue Erkennungsmechanismus sind zurzeit unbekannt.
- Aktivierung der Sekretion. Das Bakterium muss die richtige Zeit zur Sekretion erkennen. Unnötige Sekretion, wenn sich keine Wirtszelle in der Nähe befindet, ist für das Bakterium unwirtschaftlich, was Energie und Bausteine angeht. Das Bakterium kann zwar einen Kontakt der Nadel mit einer Wirtszelle spüren, der Mechanismus ist jedoch unbekannt. Manche Theorien gehen von feinen konfomationellen Veränderungen der Nadelstruktur beim Kontakt aus, die dann Veränderungen in der Konformation der Basis verursachen und damit die Sekretion einschalten.
- Binden von Chaperonen. Der Zeitpunkt, an dem Chaperone an ihren Effektoren binden (ob während oder nach der Translation), ist unbekannt, so wie auch die Art, auf die Chaperone und Effektoren sich vor der Sekretion voneinander trennen.
Quellen
- ↑ Salmond GP, Reeves PJ: Membrane traffic wardens and protein secretion in Gram-negative bacteria. In: Trends Biochem Sci. 18, 1993, S. 7-12
- ↑ Blocker A, Jouihri N, Larquet E, Gounon P, Ebel F, Parsot C, Sansonetti P, Allaoui A: Structure and composition of the Shigella flexneri 'needle complex’, a part of its type III secreton. In: Mol Microbiol. 39, 2001, S. 652-663
- ↑ Galan JE, Wolf-Watz H: Protein delivery into eukaryotic cells by type III secretion machines. In: Nature. 444, 2006, S. 567-573
Siehe auch
Wikimedia Foundation.