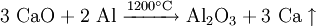- Kalzium
-
Eigenschaften Allgemein Name, Symbol, Ordnungszahl Calcium, Ca, 20 Serie Erdalkalimetalle Gruppe, Periode, Block 2, 4, s Aussehen silbrig weiß CAS-Nummer 7440-70-2 Massenanteil an der Erdhülle 3,39 % Atomar Atommasse 40,078 u Atomradius (berechnet) 180 (194) pm Kovalenter Radius 174 pm Elektronenkonfiguration [Ar]4s2 Elektronen pro Energieniveau 2, 8, 8, 2 Austrittsarbeit 2,9 eV 1. Ionisierungsenergie 589,8 kJ/mol 2. Ionisierungsenergie 1145,4 kJ/mol Physikalisch Aggregatzustand fest Kristallstruktur kubisch flächenzentriert Dichte 1,55 g/cm3 Mohshärte 1,75 Magnetismus paramagnetisch Schmelzpunkt 1115 K (842 °C) Siedepunkt 1757 K (1484 °C) Molares Volumen 26,20 · 10−6 m3/mol Verdampfungswärme 153,6 kJ/mol Schmelzwärme 8,54 kJ/mol Dampfdruck 254 Pa bei 1112 K Schallgeschwindigkeit 3810 m/s bei 293,15 K Spezifische Wärmekapazität 632 J/(kg · K) Elektrische Leitfähigkeit 29,8 · 106 A/(V · m) Wärmeleitfähigkeit 201 W/(m · K) Chemisch Oxidationszustände +2 Oxide (Basizität) CaO (stark basisch) Normalpotential −2,87 V (Ca2+ + 2e− → Ca) Elektronegativität 1,00 (Pauling-Skala) Isotope Isotop NH t1/2 ZM ZE MeV ZP 40Ca 96,941 %
Stabil 41Ca 103.000 a ε 0,421 41K 42Ca 0,647 %
Stabil 43Ca 0,135 %
Stabil 44Ca 2,086 %
Stabil 45Ca 162,61 d β- 0,257 45Sc 46Ca 0,004 %
Stabil 47Ca 4,536 d β- 1,992 47Sc 48Ca 0,187 %
> 6 · 1018 a β-β- 4,272 48Ti NMR-Eigenschaften Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [1] 
Leicht-
entzündlich(F) R- und S-Sätze R: 15 S: (2)-8-24/25-43 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet.
Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen.Calcium (fachsprachlich) oder Kalzium ist ein chemisches Element im Periodensystem der Elemente mit dem Symbol Ca und der Ordnungszahl 20.
Das glänzende silberweiße Metall begegnet uns in der Umwelt nur in gebundener Form als Bestandteil von Mineralien wie z. B. Kalkstein (auch als Calcit, Kalkspat oder Marmor), Kreide und Gips; außerdem ist es wesentlicher Bestandteil der Knochen.
Inhaltsverzeichnis
Geschichte
Der Name „Calcium“ leitet sich vom lateinischen calx ab. So bezeichneten die Römer Kalkstein, Kreide und daraus hergestellten Mörtel.
Elementares Calcium gewann erstmals Humphry Davy 1808 durch Abdampfen des Quecksilbers aus elektrolytisch gewonnenem Calciumamalgam.
Vorkommen
Calcium ist das fünfthäufigste Element der Erdkruste. Aufgrund seiner chemischen Reaktivität kommt es nur chemisch gebunden natürlich vor. Calciumhaltige Minerale wie Calcit und Gips sind in großen Mengen vorhanden (z. B. bestehen die Alpen vorwiegend aus Kalkstein).
Als essentieller Bestandteil der belebten Materie ist es am Aufbau von Blättern, Knochen, Zähnen und Muscheln beteiligt. Neben K+, Na+ spielt Ca2+ eine wichtige Rolle bei der Reizübertragung in Nervenzellen. Aber auch in anderen Zellen spielen Calcium-Ionen eine wichtige Rolle bei der Signaltransduktion.
Eigenschaften
Calcium ist weicher als Blei, lässt sich aber mit einem Messer nicht schneiden. In der Luft läuft es schnell an. Mit Wasser reagiert es heftig unter Bildung von Calciumhydroxid und Wasserstoff. An der Luft verbrennt es zu Calciumoxid und ein wenig Calciumnitrid. Fein verteiltes Calcium ist selbstentzündlich.
Calcium gehört zu den Erdalkalimetallen und liegt in chemischen Verbindungen fast nur in der Oxidationszahl +2 vor, d. h. Calciumionen sind doppelt positiv geladen.
Herstellung
Das Metall wird unter Vakuum durch Reduktion von gebranntem Kalk (Calciumoxid) mit Aluminiumpulver bei 1200 °C (Pidgeon-Prozess) hergestellt. Aluminium hat zwar eine geringere Reaktivität und Enthalpie als Calcium, so dass das Gleichgewicht der Reaktion
eigentlich fast völlig auf der linken Seite dieser Gleichung liegt. Trotzdem funktioniert dieser Herstellungsprozess, weil das entstehende Calcium bei dieser Temperatur ständig verdampft und so aus dem Gleichgewicht verschwindet. Eine Reinigung erfolgt durch Destillation des Calciums.
Verwendung
Metallisches Calcium dient als Reduktionsmittel in der Metallurgie zur Herstellung von Metallen wie Thorium, Vanadium, Zirconium, Yttrium und anderen Metallen der seltenen Erden, als Reduktionsmittel in der Stahl- und Aluminiumherstellung, als Legierungszusatz in Aluminium-, Beryllium-, Kupfer-, Blei- und Magnesiumlegierungen. Ausgangsstoff zur Herstellung von Calciumhydrid.
Die technische Nutzung des Calciums erfolgt überwiegend in gebundener Form.
Kalkstein ist einer der wichtigsten Rohstoffe der heutigen Industrie :
- Verschlackungsmittel in der Stahlherstellung. Der Verbrauch liegt bei 0,5 Tonnen Kalkstein pro Tonne Stahl
- Ausgangsstoff zur Herstellung von gebranntem Kalk
- Kreide als Füllstoff für Kunststoffe, zum Beispiel PVC. Ziel ist die Verbesserung der Steifigkeit und Schlagzähigkeit, sowie eine Verringerung der Schrumpfung. Die ebenfalls stark erhöhte thermische Leitfähigkeit erlaubt höhere Arbeitstakte beim Extrudieren.
- Feinkörniges Calciumcarbonat dient als Füllstoff von hochwertigem, holzfreiem Papier
Calciumsulfat (Gips) wird als Baustoff verwendet
Calciumcarbid dient als Ausgangsstoff für chemische Synthesen und zur Herstellung von Kalkstickstoff-Dünger
Calciumchlorid dient als Tau- und Trocknungsmittel sowie als Beton-Abbindebeschleuniger
Nachweis
Neben der bei Calcium orange-roten Flammenfärbung weist man Calcium-, Strontium- und Barium-Kationen mit Schwefelsäure oder Ammoniumsulfatlösung nach. Bei dieser Nachweisreaktion entstehen weiße, säure-unlösliche Niederschläge. Auch mit Carbonat-, Oxalat- und Dichromat-Anionen können Niederschläge unterschiedlich geringer Löslichkeit erzeugt werden. Deren genauere Untersuchung lässt dann eine Unterscheidung der Erdalkalimetall-Kationen zu (vgl. unter Kationentrenngang und Ammoniumcarbonatgruppe).
In der Routineanalytik (Klinische Chemie, Umweltchemie, Wasserchemie) wird Calcium bis in den Spurenbereich mit der Flammenphotometrie quantitativ bestimmt. Die Bestimmungsgrenze liegt bei 100 µg/l.[2] In höheren Konzentrationen ist auch die Titration mit EDTA gegen Eriochromschwarz T möglich. Zur gravimetrischen Bestimmung von Calcium fällt man dieses mit Oxalat und glüht es bei 600 °C aus, um die Wägeform Calciumcarbonat zu erhalten.
Funktionen im menschlichen Organismus
Calcium ist ein Mengenelement (Definition: Element mit mehr als 50 mg pro kg Körpergewicht) und gehört damit nicht zu den Spurenelementen. Mit einem Körperbestand von 1–1,1 kg ist Calcium der mengenmäßig am stärksten vertretene Mineralstoff im menschlichen Organismus. 99 % des im Körper vorkommenden Calciums befinden sich in Knochen und Zähnen – die calciumreiche Verbindung Hydroxylapatit (Ca5(PO4)3(OH)) verleiht ihnen Stabilität und Festigkeit. Gleichzeitig dienen die Knochen als Speicher für Calcium – bei Calciummangel kann ein Teil davon aus den Knochen gelöst und für andere Aufgaben zur Verfügung gestellt werden. Die Knochenentkalkung, Osteoporose, kommt vor allem bei älteren Menschen vor. Innerhalb der Zellen ist Calcium an der Erregung von Muskeln und Nerven, dem Glykogen-Stoffwechsel, der Zellteilung sowie an der Aktivierung einiger Enzyme und Hormone beteiligt. Wie erstmals Setsuro Ebashi nachwies, führt erst der Einstrom von Calcium-Ionen in die Muskelzellen zu einer Kontraktion der Muskulatur. Außerhalb der Zellen ist Calcium an der Blutgerinnung und der Aufrechterhaltung der Zellmembranen beteiligt. Im Blut muss ständig eine Konzentration von 2,1–2,6 mmol/l Calcium gegeben sein. Sie wird durch die Hormone Calcitriol, Calcitonin und Parathormon reguliert. Nur 0,1 % des im Körper vorhandenen Calciums findet sich im Extrazellulärraum, davon ist 30–55 % an Proteine gebunden, 5–15 % liegt in Form von Komplexen vor (z. B. Calciumhydrogencarbonat, Calciumcitrat, Calciumsulfat, Calciumphosphat oder Calciumlactat). Nur ca. 50 % des extrazellulären Calcium liegt in frei ionisierter und damit in biologisch aktiver Form vor.[3]
Ein erhöhter Calcium-Spiegel im Blut wird als Hyperkalzämie bezeichnet, ein zu niedriger Calcium-Spiegel als Hypokalzämie.
Gesundheitliche Risiken
Neueren Studien zufolge könnte das Risiko für Arterienverkalkung mit häufigen und schwerwiegenden Folgen wie Demenz, Herzinfarkt und Schlaganfall infolge eines hohen Anteils an Calcium und Vitamin D in der Nahrung lange unterschätzt worden sein.[4] So besteht laut zwei unabhängig voneinander durchgeführten Studien ein Zusammenhang zwischen dem Calcium- und Vitamin-D-Gehalt im Körper und Schädigungen des Hirngewebes im Alter.[5] Besonders bei älteren Menschen oder solchen mit Nierenschäden könnte die Gefahr bestehen, dass sich aufgenommenes Calcium schädlich auswirkt.[6]
Ernährungsempfehlungen
Risikogruppen für eine unzureichende Calciumzufuhr sind junge Frauen, Schwangere, Stillende und Senioren.
Die empfohlene Tageszufuhr für Erwachsene liegt je nach Gesundheitsbehörde zwischen 450 und 1000 mg. Voraussetzung dafür, dass Calcium in größeren Mengen vom Körper aufgenommen werden kann, ist eine ausreichende Versorgung mit Vitamin D3. Durch die gleichzeitige Zufuhr von Oxalsäure, Phytinsäure und Ballaststoffen wird die Calciumaufnahme verringert. Ausgeschieden wird Calcium über den Harn und über den Stuhl, wobei unter anderem eine hohe Zufuhr von Eiweiß, Speisesalz, Kaffee oder Alkohol die Calciumausscheidung erhöht. Vor allem tierisches Eiweiß ist für eine erhöhte Calciumausscheidung verantwortlich. Dies liegt daran, dass das tierische Eiweiß viele Aminosäuren enthält, in denen Schwefel enthalten ist. Der Schwefel bildet im Stoffwechsel Säuren, die eine Entmineralisierung der Knochen auslösen.
Empfohlene Calciumzufuhr nach Alter Alter Empfohlene tägliche Zufuhr (mg) Säuglinge unter 4 Monate 220 4 bis 12 Monate 400 Kinder 1 bis 4 Jahre 600 4 bis 7 Jahre 700 7 bis 10 Jahre 900 10 bis 13 Jahre 1100 Jugendliche und Erwachsene 13 bis 19 Jahre 1200 19 bis 50 Jahre 1000 Senioren ab 50 1200 (geringere Resorptionsfähigkeit) Die empfohlene Calciumaufnahme ist in vielen Ländern unterschiedlich, was die Unsicherheit über den tatsächlichen Bedarf widerspiegelt. Hinzu kommt, dass der menschliche Verdauungstrakt die Absorption dem jeweiligen Bedarf und der zur Verfügung stehenden Menge anpasst. So ist es schwierig, die untere Grenze des Calciumbedarfs festzulegen, da diese stark von der Lebens- und Ernährungsweise des jeweiligen Menschen abhängt. So kann es dazu kommen, dass der Mensch von 800 mg aufgenommenen Calciums nur etwa 15 % absorbiert. Im Allgemeinen geht man davon aus, dass ein durchschnittlicher Erwachsener etwa 30 bis 40 % des aufgenommenen Calciums absorbiert. Bei Säuglingen, bei Schwangeren und bei stillenden Frauen erhöht sich dieser Wert auf bis zu 75 %.
Empfohlener Tagesbedarf an Calcium in mg Kinder Jugendliche Erwachsene ÖGN* 600–900 1100–1200 1000 USA 800 1200 800 Kanada 500–700 1000–1100 700–800 GB 600 700 500 Japan 400 900 600 Korea 500–700 800 600 WHO 450 650 450 ÖGN* = Österreichische Gesellschaft für Ernährung
Calciumgehalt einiger ausgewählter Lebensmittel
Ungefähre Menge in mg an Calcium im jeweiligen Lebensmittel pro 100 g verzehrbaren Anteil
- Samen
- Mohn: 2500
- Sesam: 800
- Mandel, Haselnüsse und Amarant: 200 bis 250
- Paranüsse: 170
- Gekochte Sojabohnen: 70
- Hafermehl und Sonnenblumenkerne: 50
- Milchprodukte
- Käse
- Hartkäse: 1100 bis 1300
- Schnittkäse: 500 bis 1100
- Weichkäse: 300 bis 500
- Milch: 100 bis 150
- Rohmilch
- Vollmilch
- H-Milch
- Buttermilch
- Dickmilch
- Fettarme Milch (1,5 % Fett)
- Joghurt und Kefir: 100 bis 150
- Molke: 70 bis 100
- Käse
- Gemüse
- Brennnesseln: 360
- Grünkohl, Petersilie: 200 bis 250
- Brunnenkresse, Löwenzahn und Rucola: 150 bis 200
- Chinakohl, Fenchel, Broccoli, Meerrettich: 100 bis 150
- Bleichsellerie: 80
- Rote Rüben: 20
- Früchte
- Getrocknete Feigen: 250
- Vollkornbrot: 50
Verbindungen
- Apatit
- Calciumacetat
- Calciumbromid
- Calciumcarbid
- Calciumcarbonat, Kalkstein, Marmor
- Calciumcitrat
- Calciumchlorid
- Calciumfluorid
- Calciumgluconat (parentales Calcium)
- Calciumhydroxid, gelöschter Kalk
- Calciumlactat
- Calciumlactatgluconat
- Calciumnitrat
- Calciumoxid, gebrannter Kalk
- Calciumphosphat
- Calciumpropionat
- Calciumproprionat
- Calciumsilikat
- Calciumsulfat, Gips
- Calciumdinatriumethylendiamintetraacetat
Siehe auch
Einzelnachweise
- ↑ Eintrag zu CAS-Nr. 7440-70-2 im European chemical Substances Information System ESIS
- ↑ K. Cammann (Hrsg.), Instrumentelle Analytische Chemie, Spektrum Akademischer Verlag, Heidelberg-Berlin, 2001, S. 4–60.
- ↑ Laura M. Calvi and David A. Bushinsky: „When Is It Appropriate to Order an Ionized Calcium?.“ J Am Soc Nephrol Jahr; 19: S. 1257–1260 Abstract
- ↑ http://www.beatrice-sonhueter.de/fileadmin/pdf/Pressetext-Gefaehrliches-Calcium.pdf
- ↑ http://www.focus.de/gesundheit/ratgeber/gehirn/news/ernaehrung_aid_55130.html
- ↑ http://www.dradio.de/dkultur/sendungen/mahlzeit/743665/
Weblinks
- WebElements.com – Calcium
- EnvironmentalChemistry.com – Calcium
- Heilmittel Calcium bei Phytodoc
- Calcium Calculator – Ein Tool zur Berechnung der eingenommenen Menge Kalzium (engl.)
- Laborlexikon: Calcium
H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga As Br Kr Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Te I Xe Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Rn Fr Ra Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Rf Db Sg Bh Hs Mt Ds Rg Uub Uut Uuq Uup Uuh Uus Uuo
Alkalimetalle Erdalkalimetalle Lanthanoide Actinoide Übergangsmetalle Metalle Halbmetalle Nichtmetalle Halogene Edelgase I Fibrinogen | II Prothrombin | III Thromboplastin | IV Calcium | V Proaccelerin | VI Nicht vergeben | VII Proconvertin
VIII Antihämophiles Globulin A | IX Christmas-Faktor | X Stuart-Prower-Faktor | XI PTA (Plasma thromboplastin antecedent)
XII Hageman-Faktor | XIII Fibrinstabilisierender Faktor
Weitere Gerinnungsfaktoren: Präkallikrein | Hochmolekulares Kininogen
Wikimedia Foundation.