- Vinylacetat
-
Strukturformel 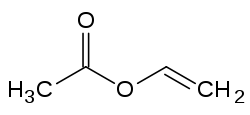
Allgemeines Name Vinylacetat Andere Namen - Essigsäurevinylester
- Ethenylester
- 1-Acetoxyethylen
- VAM
Summenformel C4H6O2 CAS-Nummer 108-05-4 PubChem 7904 Kurzbeschreibung farblose, lichtempfindliche, leichtentzündliche Flüssigkeit mit süßlichem Geruch[1]
Eigenschaften Molare Masse 86,09 g·mol−1 Aggregatzustand flüssig
Dichte 0,93 g·cm−3[1]
Schmelzpunkt Siedepunkt 72 °C[1]
Dampfdruck Löslichkeit - schlecht in Wasser (20 g·l−1 bei 20 °C)[1]
- gut löslich in gebräuchlichen Lösungsmitteln, z. B. Essigsäureethylester und Ethanol[2]
Brechungsindex 1,3956[2]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [3] 
Gefahr
H- und P-Sätze H: 225 EUH: keine EUH-Sätze P: 210 [1] EU-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [3] 
Leicht-
entzündlich(F) R- und S-Sätze R: 11 S: (2)-16-23-29-33 LD50 2920 mg·kg−1 (Ratte, peroral)[4]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C Vinylacetat ist eine chemische Verbindung aus der Gruppe der Carbonsäureester. Sie liegt in Form einer farblosen Flüssigkeit mit süßlichem Geruch vor. Vinylacetat ist chemisch instabil, lichtempfindlich und neigt dazu, spontan zu polymerisieren.
Inhaltsverzeichnis
Geschichte
Das monomere Vinylacetat wurde erstmals 1912 von Fritz Klatte bei Griesheim-Elektron dargestellt[5].
Gewinnung und Darstellung
Vinylacetat kann durch Reaktion von Ethen und Essigsäure mit Sauerstoff in Anwesenheit eines Palladium-Katalysators (z. B. in einem kontinuierlichen, homogenen Gasphasenprozess) nach dem Wacker-Verfahren hergestellt werden. Die Jahresnachfrage nach Vinylacetat beträgt in den Vereinigten Staaten ungefähr 1,14 Mio. Tonnen (Stand 2005)[4].
Eigenschaften
Physikalische Eigenschaften
Vinylacetat hat eine Viskosität von 0,43 mPa·s bei 20 °C, eine spezifische Wärmekapazität von 1,926 kJ/kg·K bei 20 °C, eine Verdampfungswärme von 379,3 kJ/kg, eine Polymerisationswärme von 1035,8 KJ/kg (bei 76,8 °C), eine Verbrennungswärme 2082,9 kJ/mol bei 25 °C.[2] Die Dämpfe von Vinylacetat sind 2,98-mal schwerer als Luft. Mit Wasser bildet Vinylacetat ein Azeotrop, welches unter Normaldruck bei 66 °C siedet und 92,7 % Vinylacetat enthält.[2]
Chemische Eigenschaften
Vinylacetat polymerisiert sehr leicht unter dem Einfluss von verschiedenen Aktivatoren, z. B. Licht oder Peroxiden, wobei auch Erwärmung ausreichend ist. Da es ein ungesättigter Ester ist, erlaubt er eine Reihe von Additions- und Umesterungsreaktionen.
Verwendung
Vinylacetat ist ein Monomer und wird überwiegend zur Herstellung von Polyvinylacetat und in geringem Umfang Vinylacetat-Copolymeren (wie Ethylenvinylacetaten oder Ethylen-Vinylalkohol-Copolymeren) und Polyvinylalkohol verwendet. Diese Polymere finden in Form von flüssigen Dispersionen, Dispersionspulver, Festharzen und Lösungen ihre Anwendung, insbesondere als Bindemittel im Bau-, Farben-, und Lacksektor und als Rohstoff für die Klebstoff-, Papier- und Textilindustrie.[6]
Sicherheitshinweise
Vinylacetat ist als krebserzeugend nach EG-Kategorie 3 (Stoffe die wegen möglicher krebserzeugender Wirkung beim Menschen Anlass zur Besorgnis geben) eingestuft. An der Luft kann Vinylacetat leicht explosive Peroxide bilden, was durch Zugabe von Stabilisatoren (z. B. Hydrochinon oder Methylhydrochinon in einer Konzentration von 3 bis 20 ppm) unterdrückt wird.
Einzelnachweise
- ↑ a b c d e f g Eintrag zu CAS-Nr. 108-05-4 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 4. Oktober 2007 (JavaScript erforderlich).
- ↑ a b c d Datenblatt bei Celanese Chemicals
- ↑ a b Eintrag zu CAS-Nr. 108-05-4 im European chemical Substances Information System ESIS (ergänzender Eintrag)
- ↑ a b Leitfaden zur sicheren Handhabung von Vinylacetat
- ↑ Datenblatt bei Kremer Pigmente
- ↑ M. D. Lechner, K. Gehrke und E. H. Nordmeier: Makromolekulare Chemie, 4. Auflage, Birkhäuser Verlag, 2010, S. 53, S. 58 u. S. S. 63, ISBN 978-3-7643-8890-4.
Kategorien:- Feuergefährlicher Stoff
- Essigsäureester
- Alken
Wikimedia Foundation.
