- Zellselbstmord
-
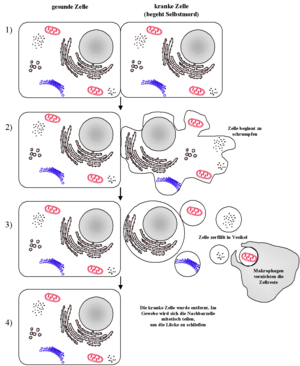
Die Apoptose (griechisch απόπτωσις von apo „weg“ und ptosis „Fall“, wie das Fallen der Blätter im Herbst[1]) ist eine Form des programmierten Zelltods. Es ist gewissermaßen ein „Selbstmordprogramm“ einzelner biologischer Zellen. Dieses kann von außen angeregt werden (etwa durch Immunzellen) oder aufgrund von zellinternen Prozessen ausgelöst werden (etwa nach starker Schädigung der Erbinformation). Im Gegensatz zum anderen bedeutenden Mechanismus des Zelltodes, der Nekrose, wird die Apoptose von der betreffenden Zelle selbst aktiv durchgeführt, ist Teil des Stoffwechsels der Zelle. Dadurch unterliegt diese Form des Zelltods strenger Kontrolle und es wird gewährleistet, dass die betreffende Zelle ohne Schädigung des Nachbargewebes zugrundegeht. Die Apoptose unterscheidet von den anderen Formen des programmierten Zelltods, dass bei ihr eine Gruppe von Enzymen, die proteolytische Aktivität aufweisen, sogenannte Caspasen, eine zentrale Rolle spielen.
Apoptose und Nekrose lassen sich schon optisch leicht unterscheiden. Während bei der Apoptose ein Schrumpfen der Zelle einsetzt und ein Abbau der DNA durch Endonukleasen in definierte Stücke stattfindet (als DNA-Leiter bekannt und mittels Elektrophorese und sog. TUNEL-Methode nachweisbar), schwillt bei der Nekrose die Zelle an, wobei deren Plasmamembran zerstört wird. Als Folge kommt es zu lokalen Entzündungen, da Cytoplasma und Zellorganellen in den Extrazellularraum freigesetzt werden, welche durch Makrophagen (Fresszellen) beseitigt werden müssen. Im Vergleich zur Nekrose ist die Apoptose die häufigere Form des Zelltods.
Inhaltsverzeichnis
Vorkommen
Während der Entwicklung eines Organismus ist Apoptose essentiell:
- bei der Metamorphose von der Kaulquappe zum Frosch oder der Degeneration der Häute zwischen den Fingern/Zehen (Interdigitalhäute) werden gezielt Zellen zur Apoptose angeregt
- durch apoptotischen Zelltod der Zellen von Glaskörper und Linse des Linsenauges wird die Lichtdurchlässigkeit der Augenlinse erreicht
- zur Gewährleistung der richtigen „Verschaltung“ von Hirnstrukturen sowie einzelner Nervenzellen sterben bis zur Hälfte aller ursprünglich entstandenen Nervenzellen noch vor der Geburt wieder ab
Aber auch im adulten Organismus ist sie unerlässlich:
- zur Kontrolle der Zellzahl und der Größe von Geweben
- bei der Verjüngung von Geweben (z. B. beim Riechepithel der Nase)
- bei Selektion und Abbau unnötiger oder potentiell schädlicher Zellen des Immunsystems
- zur Eliminierung entarteter Zellen
- zur Gewährung der Plastizität im zentralen Nervensystem
- zur Selektion von Keimzellen (ca. 95 % der Keimzellen werden vor dem Erreichen ihrer Reife apoptotisch getötet)
- bei der holokrinen Sekretion, d. h. bei den Talgdrüsen des Menschen
Gegenwärtig wird die Apoptose besonders im Zusammenhang mit der Krebsentstehung und verschiedenen Autoimmunerkrankungen erforscht. Ein Ziel der Krebsforschung ist es, kontrollierte Apoptose bei entarteten Zellen auszulösen. Doch auch die Krebszellen nutzen den Apoptosemechanismus, um menschliche Abwehrzellen, sogenannte tumorinfiltrierende Lymphozyten (TILs), auszuschalten. So findet man an der Oberfläche verschiedener Tumorzelllinien ein Apoptose-auslösendes Protein, den CD95-Liganden (Fas Ligand). Diesen Mechanismus bezeichnet man als „Tumor counterattack“.
Die Frage, welche Rolle Apoptose bei neurodegenerativen Krankheiten (wie z. B. Morbus Alzheimer, Chorea Huntington, Morbus Parkinson, ALS) spielt, ist heutzutage ebenfalls heftig diskutiert, und auf diesem Gebiet laufen verschiedenste Forschungen.
Auch in einzelligen Organismen wurden Anzeichen von Apoptose gefunden. In Saccharomyces Cerevisiae werden – besonders in alten Zellen – verschiedene Marker von Apoptose (DAPI, TUNEL-Färbung) sichtbar. Über evolutionäre Gründe für das Vorhandensein von Apoptose in Einzellern wird spekuliert. Eine Theorie besagt, dass sich einzelne schadhafte Zellen opfern und zum Wohle des Kollektivs „Selbstmord“ begehen. Dadurch werden Nährstoffe eingespart, die somit den anderen Zellen zu Verfügung stehen. Ziel ist es schließlich, das Genom zu erhalten, welches ja auch in den anderen Zellen praktisch identisch vorhanden ist.
Detaillierte Vorgänge
Der Vorgang der Apoptose lässt sich in zwei Phasen unterteilen: Initiations- und Effektorphase.
Initiationsphase
Bei der Initiationsphase unterscheidet man zwei Vorgänge: Den extrinsischen und den intrinsischen Weg. Man unterscheidet hiernach auch in Apoptose Typ I und Typ II.
extrinsischer Weg / Typ I
Der extrinsische Weg wird eingeleitet durch Ligandenbindung an einen Rezeptor der TNF-Rezeptorfamilie (z. B. CD95). Diese sogenannten Todesrezeptoren besitzen in ihrem zytoplasmatischen Teil eine Todesdomäne (DD, „death domain“). Liganden sind zum Beispiel der Tumornekrosefaktor (TNF) und andere Zytokine, die beispielsweise von T-Lymphozyten sezerniert werden.
Durch die induzierte Trimerisierung des Rezeptors bilden die Todesdomänen eine Struktur, an die nun Adaptermoleküle mit eigener Todesdomäne durch homotypische Interaktionen binden können. In einem ersten Schritt wird das „TNF-Rezeptor assoziierte Protein“ (TRADD) rekrutiert. Anschließend bindet an die DD des TRADD das „Fas assoziierte Protein mit Todesdomäne“ (FADD). FADD besitzt neben der DD auch eine Todeseffektordomäne (DED, „death effector domain“), über die die proCaspase 8 mit ihrer DED an den Komplex bindet. Diese kann sich nun durch die entstandene hohe lokale Konzentration autokatalytisch aktivieren. Die aktive Caspase 8 löst ihrerseits die sogenannte Caspase-Kaskade aus, wodurch in einer signalverstärkenden Rückkopplung weitere Caspase-8-Moleküle aktiviert werden.
Über diesen Mechanismus sterben beispielsweise bei AIDS-Patienten auch zahlreiche nicht infizierte Leukozyten ab: Das HI-Virus regt mittels des Proteins Nef noch nicht erkrankte Abwehrzellen zum programmierten Zelltod an. Der Hemmstoff Fasudil-Hydrochlorid kann diesen Mechanismus unterbinden.
intrinsischer Weg / Typ II
Beim intrinsischen Weg oder der Apoptose des Typs II kommt es durch noch nicht genau bekannte Mechanismen zur Freisetzung von Cytochrom c und anderen pro-apoptotischen Faktoren wie Smac/DIABLO aus den Mitochondrien in das Zytoplasma. Dieser Weg kann ausgelöst werden durch Tumor-Suppressoren, wie beispielsweise p53, einem Transkriptionsfaktor, der durch Schädigung der DNA aktiviert wird. p53 stimuliert die Expression pro-apoptotisch wirkender Mitglieder der Bcl-2 Familie (z. B. Bax, Bad). Diese führen dann zur Freisetzung der pro-apoptotischen Faktoren – wie etwa Cytochrom c – aus dem mitochondrialen Intermembranraum. Es wirken jedoch viele toxische Substanzen wie z. B. Chemotherapeutika auch direkt auf die Mitochondrien und können so die Typ II Apoptose induzieren. Durch die Bindung von Cytochrom c und dATP an Apaf-1 (apoptotischer Protease-Aktivierungsfaktor-1) wird eine Konformationsänderung des Proteins verursacht. Durch diese Konformationsänderung wird die Proteinbindedomäne CARD (Caspase-Rekrutierungs-Domäne) von Apaf-1 zugänglich, so dass sie an die CARD Domäne der Procaspase 9 binden kann. Die Bildung dieses Heterodimers ist eine Voraussetzung für die autolytische Aktivierung der Caspase 9. Dieser Komplex wird Apoptosom genannt und stellt die aktive Form der Caspase 9 dar. Analog zu Caspase 8 initiiert aktive Caspase 9 die Caspase-Kaskade. Eine Signalverstärkung dieses Weges wird innerhalb der Caspase-Kaskade durch Caspase 7 vermittelt, welche nicht nur Substrate spaltet, die an der Ausführung der Apoptose beteiligt sind, sondern ihrerseits auch die Caspase 9 aktiviert.
Zellen, die vielleicht auf Grund einer zu geringen intrazellulären Menge an Caspase 8 nicht die Typ I Apoptose zu initiieren vermögen, können den mitochondrialen Weg zur Signalverstärkung aktivieren. Dazu spaltet die Caspase 8 das zytosolische Protein Bid („BH3 interacting domain death agonist“). Das entstehende C-terminale Spaltprodukt tBid („truncated Bid“) vermittelt nach der Translokation in die Mitochondrien die Freisetzung von pro-apoptotischen Faktoren und führt zur Aktivierung der Caspase 9.
Effektorphase und Caspase-Kaskade
Sogenannte Effektorcaspasen, vornehmlich Caspasen 3, 6 und 7 führen zum apoptotischen Tod der Zelle. Sie aktivieren einerseits sekundäre Zielproteine (z. B. Caspase aktivierte DNase, CAD, oder andere Caspasen) durch limitierte Proteolyse. Andererseits sind sie selbst aktiv am Abbau von Lamin (in der Zellkernmembran) und Actin (Teil des Zytoskeletts) beteiligt. Ein weiterer Aspekt ist die caspasevermittelte Unterdrückung der DNA-Reparatur.
Letztendlich schnürt sich die Zelle nach und nach in kleinen Vesikeln ab, die wiederum durch spezialisierte „Fresszellen“ (Phagozyten) aufgenommen werden. Im Gegensatz zur Nekrose bleibt hierbei die Zellmembran intakt.
Der Austritt von Cytochrom c aus Mitochondrien ins Zytoplasma, der ein allgegenwärtiges Anzeichen für Apoptose ist, tritt beim extrinsischen Weg erst spät während der Apoptose auf und ist eher Resultat der Apoptose als ihr Auslöser.
Beim extrinsischen Weg unterscheidet man ferner zwischen aktiver (durch Aktivierung von Rezeptoren induziert) und passiver (ausgelöst durch Entzug von Wachstumsfaktoren, z. B. Neurotrophine) Apoptose.
Die wichtigsten bei der Unterdrückung der Apoptose beteiligten Proteine sind die anti-apoptotischen Mitglieder der Bcl-2 Familie (Bcl-2 und Bcl-xL) und die IAPs (Apoptose-inhibitorische Proteine, engl. inhibitor-of-apoptosis proteins), wie beispielsweise Survivin. Weiter stromaufwärts liegen die Proteinkinase B (Alternativbezeichnung: Akt), z. B. in Zusammenhang mit Rezeptoren der Trk-Familie (siehe Neurotrophin) und Transkriptionsfaktoren der FOXO-Familie, und der Transkriptionsfaktor NF-κB.
Nobelpreis für Medizin
Für ihre Entdeckungen, die genetischen Regulation der Organentwicklung und des programmierten Zellsterbens betreffend, erhielten die Wissenschaftler Sydney Brenner (Großbritannien), H. Robert Horvitz (USA) und John E. Sulston (Großbritannien) im Jahre 2002 den Nobelpreis für Medizin.
Quellen
- M. O. Hengartner: The biochemistry of apoptosis. In: Nature. Bd. 407, Nr. 6805, 2000, ISSN 0028-0836, S. 770–776 (engl., kein freier Zugriff). PMID 11048727
- J. Yuan, B. A. Yankner: Apoptosis in the nervous system. In: Nature. Bd. 407, Nr. 6805, 2000, ISSN 0028-0836, S. 802–809 (engl., kein freier Zugriff). PMID 11048732
- ↑ Science & Medicine. 1, Nr. 1, 1994, S. 88, http://www.sciandmed.com/sm/journalviewer.aspx?issue=1075&article=872
Literatur
- Hubert Hug: Apoptose: Die Selbstvernichtung der Zelle als Überlebensschutz. In: Biologie in unserer Zeit. Band 30(3), 2000, S. 128–135, ISSN 0045-205X.
- Stefan Grimm: Die Apoptose: Programmierter Zelltod. In: Chemie in unserer Zeit. Band 37(3), 2003, S. 172–178, ISSN 0009-2851
- Fritz Höffeler: Die Maschinerie der Apoptose: Chronik eines angekündigten Todes. In: Biologie in unserer Zeit. Band 34(1), 2004, S. 1623, ISSN 0045-205X.
Weblinks
- aufwändige Animation zur Apoptose (Video, ca. 35 MB)
- Nobelpreis für Medizin und Physiologie 2002
- Apoptopedia. Eine Einführung in die Apoptose-Forschung mit Review und Glossar.
- Apoptosis.Info. Eine Seite rund um Apoptose u. a. mit Apoptosis News, Apoptosis Protocols, Apoptosis Links etc.
- A. Lawen: Apoptosis – an introduction. In: BioEssays. Band 25, 2003, S. 888–896.
- Graphiken und Aufnahmen zur Apoptose / Vergleich zur Nekrose
Wikimedia Foundation.