- Zineryt
-
Strukturformel 
Erythromycin AAllgemeines Freiname Erythromycin Andere Namen 6-(4-Dimethylamino-3-hydroxy-6-methyl- oxan-2-yl)oxy-14-ethyl-7,12,13-trihydroxy- 4-(5-hydroxy-4-methoxy-4,6-dimethyl- oxan-2-yl)-oxy-3,5,7,9,11,13-hexamethyl- 1-oxacyclotetradecan-2,10-dion
Summenformel C37H67NO13 CAS-Nummer 114-07-8 PubChem 12560 ATC-Code DrugBank DB00199 Kurzbeschreibung weißer bis gelber, kristalliner Feststoff [1] Arzneistoffangaben Wirkstoffklasse Makrolid-Antibiotikum
Fertigpräparate - Aknefug-EL®
- Erythromycin®, Ery-...®
- Infectomycin®
- Paediathrocin®
- Sanasepton®
- Zineryt®
- Inderm®
- Stiemycine®
Verschreibungspflichtig: Ja Eigenschaften Molare Masse 733,93 g·mol−1 Schmelzpunkt pKs-Wert 8,6–8,8 [2]
Löslichkeit sehr gering
(Nimmt mit zunehmender Temperatur ab) [2]Sicherheitshinweise Gefahrstoffkennzeichnung [3] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Erythromycin bezeichnet eine Gruppe organischer chemischer Verbindungen, die zu den Glycosiden zählen. Die natürlichen Antibiotika werden von verschiedenen Actinobacteria-Gattungen (Streptomyceten) produziert, wonach die Gruppe auch benannt wurde. Industriell wird Erythromycin aus Streptomyces erythreus (Saccharopolyspora erythraea) gewonnen. In der Medizin wird es als Makrolidantibiotikum mit einem weiten Spektrum gegen grampositive Keime (Streptokokken, Staphylokokken), Anaerobier (P. acnes, Corynebakterien) sowie Mykoplasmen eingesetzt. Bei Erythromycin handelt es sich um die Leitsubstanz der Makrolidantibiotika, welche am häufigsten eingesetzt wird. Die Substanz ist gut verträglich und insbesondere bei der Akne papulopustulosa wirksam.
Inhaltsverzeichnis
Geschichte
1949 schickte Abelardo Aguilar, ein philippinischer Wissenschaftler, Bodenproben aus der Provinz Iloilo an seinen Arbeitgeber, dem Pharmaunternehmen Lilly. Dort isolierte eine Arbeitsgruppe unter J. M. McGuire Erythromycin als Stoffwechselprodukt von Streptomyces erythreus (heute Saccharopolyspora erythraea). Seit 1952 als Ilosone® vermarktet erhielt Lilly 1953 das U.S. Patent 2,653,899 für diese Verbindung. Die Totalsynthese des Erythromycins gelang Robert B. Woodward und Mitarbeitern 1981.[4][5][6]
Klinische Angaben
Die Behandlung mit dem Wirkstoff Erythromycin erfolgt in der Regel aber nicht sehr lang (wenige Wochen), denn entweder ist die Kur erfolgreich oder die Erreger sind nach dieser Zeit resistent. In beiden Fällen ist die weitere Behandlung natürlich nicht sinnvoll.
Erythromycin ist nicht säurestabil und wird daher in Form von magensaftresistenten Tabletten gegeben, kann aber auch in Form von Tupflösung oder Salben (z. B. zur lokalen Anwendung bei Akne) verabreicht werden. Eine weitere Möglichkeit, Erythromycin magensäureresistent zu machen, besteht in einer chemischen Veränderung des Wirkstoffs. Dazu wird der Wirkstoff verestert, wobei dessen Wirkung nicht beeinflusst wird.
Das Wirkungsspektrum von Erythromycin ist mit dem Wirkungsspektrum von einigen Penicillinen vergleichbar, wodurch sich ähnliche Anwendungsgebiete ergeben. Daher kann Erythromycin eingesetzt werden, wenn Allergien gegen β-Lactam-Antibiotika bestehen oder wenn Resistenzen deren Anwendung verhindern.
Erythromycin ist ein Hemmstoff des Cytochroms CYP3A4.[7] Somit ist die Biotransformation von Medikamenten, bei denen dieses Enzym beteiligt ist, z. B. Ciclosporin, Diazepam, Lidocain, Warfarin u. v. a., beeinträchtigt, was zur Wirkstoffakkumulation und zur Verstärkung von Haupt- und Nebenwirkungen führt.[8]
Wirkungsmechanismus
Erythromycin hemmt den durch den Elongationsfaktor EF-G katalysierten Vorgang der Translokation bei der Translation. EF-G hat dabei die Funktion einer GTP-ase, bewirkt also den Zerfall von GTP in GDP+Pi. Die dabei frei werdende Energie wird genutzt, um die freien tRNA-Moleküle aus dem Ribosom zu lösen und so dessen Fortbewegung zu ermöglichen. Ein Fehlen des Elongationsfaktors verhindert die Proteinsynthese.
Chemie
Erythromycin (A) ist in Wasser schwer löslich und bildet farblose bis schwach gelbliche Kristalle. Das Makrolidantibiotikum hat einen 14-gliedrigen Lactonring ohne Doppelbindungen. An jedem zweiten C-Atom ist es methylverzweigt und ist glykosidisch mit Cladinose (C3) bzw. Desoamin (C5) verknüpft.
In Medikamenten ist Erythromycin A als Hauptkomponente enthalten, jedoch finden sich auch ca. 5 % Erythromycin B und C.[9]
Die Erythromycine sind trocken stabil, zersetzen sich jedoch in Lösung schon bei Raumtemperatur allmählich. Beim Erhitzen über 60 °C sowie in saurer oder alkalischer Lösung geschieht der Abbau rapide.[2]
Struktur der Erythromycine Erythromycin Allgemeine Struktur R1 R2 A 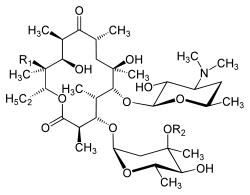
–OH –CH3 B –H –CH3 C –OH –H Abgeleitete Verbindungen
- Erythromycin ethylsuccinat (CAS 41342-53-4)
- Erythromycin lactobionat (CAS 3847-29-8)
- Erythromycin stearat (CAS 643-22-1)
Einzelnachweise
- ↑ a b c d e MSDS beim Hersteller Merck
- ↑ a b c d F. von Bruchhausen, S. Ebel, A. W. Frahm, E. Hackenthal: Hagers Handbuch der Pharmazeutischen Praxis. Bd. 8 Stoffe E–O 5. Auflage, S. 70, Birkhäuser, 1991, ISBN 9783540526889
- ↑ Erythromycin beim Hersteller Sigma-Aldrich
- ↑ Woodward, R.B. et al. (1981): Asymmetric Total Synthesis of Erythromycin. 1. Synthesis of of an Erythronolide A Seco Acid Derivative via Asymmetric Induction. In: Journal of the American Chemical Society. 103:3210.
- ↑ Woodward R.B. et al. (1981): Asymmetric Total Synthesis of Erythromycin. 2. Synthesis of an Erythronolide A Lactone System. In: Journal of the American Chemical Society. 103:3213.
- ↑ Woodward R.B. et al. (1981): Asymmetric Total Synthesis of Erythromycin. 3. Total Synthesis of Erythromycin. In: Journal of the American Chemical Society. 103:3215.
- ↑ Ray, WA. et al. (2004): Oral Erythromycin and the Risk of Sudden Death from Cardiac Causes. In: N. Engl. J. Med. 351(11); 1089–1096. PMID 15356306 PDF (freier Volltextzugriff, engl.)
- ↑ Robertson, GR. et al. (2003): Transgenic mouse models of human CYP3A4 gene regulation. In: Mol Pharmacol. 64(1); 42–50. PMID 12815159 PDF (freier Volltextzugriff, engl.)
- ↑ Theodor Dingermann (Hrsg.), Rudolf Hänsel (Hrsg.) und Ilse Zündorf (Hrsg.): Pharmazeutische Biologie: Molekulare Grundlagen und klinische Anwendungen. Springer Verlag Berlin; 1. Auflage 2002; ISBN 3-540-42844-5; S. 316f
Weblinks
- Informationen bei MedlinePlus (englisch)
Bitte beachte den Hinweis zu Gesundheitsthemen!
Wikimedia Foundation.
