- C-H-Acidität
-
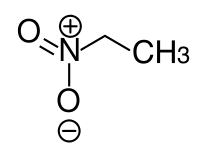
Als CH-Acidität bezeichnet man die Neigung einer organischen chemischen Verbindung, an einem Kohlenstoff-Atom gebundene Wasserstoffatome als Protonen abzugeben und damit als Säure zu agieren. Da Kohlenstoff selbst nicht sehr viel elektronegativer als Wasserstoff ist, ist die C-H-Bindung in der Regel, im Gegensatz zu N-H- und O-H-Bindungen, nicht sehr polar und die Bereitschaft, ein Carbanion zu bilden, dementsprechend gering. Dies führt zu sehr hohen Säurekonstanten bei unsubstituierten Alkanen, z. B. pKS ca. 50 für Ethan.[1] Ist das Kohlenstoffatom jedoch an stark elektronenziehende Gruppen wie Carbonyle, Sulfone, Trifluormethyl- oder Nitrogruppen gebunden (α-ständig zu diesen Gruppen), so sorgt der stark ausgeprägte negative induktive Effekt dafür, dass die C-H-Bindung stärker polarisiert und das Proton leichter abspaltbar wird.
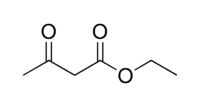
Praktisch angewendet wird dies bei Reaktionen mit Enolaten, beispielsweise der Knoevenagel-Kondensation. Bei Einsatz von Derivaten der Malonsäure (pKS ≈ 13) oder Acetylaceton (pKS ≈ 9), die als β-Dicarbonyle recht gut deprotonierbar sind, können diese Reaktionen schon mit vergleichsweise milden Basen wie Ethanolaten oder Triethylamin durchgeführt werden.
Ebenso sorgen C-C-Mehrfachbindungen durch Annäherung der Kohlenstoffatome für eine stärkere Polarisierung, so dass Acetylen mit einem pKS von ca. 25 relativ CH-acide ist und Acetylide, z. B. Silberacetylid, bilden kann.
Bedeutung
Dem pKS-Wert von CH-aciden Verbindungen kommt bei verschiedenen chemischen Verfahren und Prozessen eine hohe Bedeutung zu. So erhält man etwa durch die Deprotonierung der sehr schwach sauren Alkane sehr starke Basen, wie z. B. in Butyllithium. Andererseits nutzt man die hohe Säurestärke aktivierter Verbindungen (s. o.) um C-C-Verknüpfung durchzuführen. Auch wenn die CH-Acidität sehr gering ist, kann sie eine entscheidende Rolle bei chemischen Prozessen spielen, z. B. bei der Racemisierung von Hyoscyamin zu Atropin.
Literatur
Siehe auch:
- OH-Acidität
- NH-Acidität
- SH-Acidität
- organische Säure
Wikimedia Foundation.