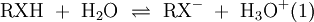- Organische Säure
-
Organische Säuren sind organische chemische Verbindungen, die über eine funktionelle Gruppe verfügen, die mit Wasser oder anderen protonierbaren Lösungsmitteln eine Gleichgewichtsreaktion eingeht. Dabei entsteht im Fall von Wasser das Oxoniumion H3O+, das die Lösung sauer werden lässt, während die Säure ein Proton an das Lösungsmittel Wasser abgibt:
Meist wird der Begriff Organische Säure mit Carbonsäure gleichgesetzt, es gibt jedoch auch organische Säuren, die keine Carboxylgruppe tragen. Als Maß für die Säurestärke gilt die Säurekonstante (bzw. der pKs-Wert) eines Stoffes. Diese Werte geben an, inwieweit eine Säure bei der Gleichgewichtsreaktion mit Wasser protolysiert, d.h. wie weit die Gleichung (1) auf die rechte Seite verschoben ist. Dabei gilt: je kleiner der pKs-Wert ist, desto größer ist die Säurestärke des Stoffes.
Inhaltsverzeichnis
Gruppen organischer Säuren
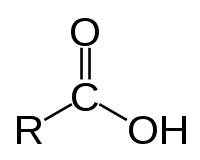
Mitglieder der Gruppe der Carbonsäuren besitzen eine oder mehrere Carboxylgruppen (–COOH), die sauer reagieren. Es können aber auch andere Gruppen wie die Hydroxylgruppe (–OH), Sulfanylgruppe –SH (Thiole) oder –SO3H (Sulfonsäuren) vorhanden sein, die Protonen abspalten können. Eine saure Reaktion einer Verbindung wird erleichtert, wenn das resultierende Anion durch Mesomerie stabilisiert wird. So hat Ascorbinsäure (Vitamin C) keine Carboxylgruppe, wirkt aber durch seine Enolgruppen sauer. Auch die Acidität von Phenol und Acetessigester sind auf die Stabilisierung der Anionen zurückzuführen.
Carbonsäuren
Hauptartikel: Carbonsäuren
Carbonsäuren haben in der Regel einen deutlich saureren Charakter als beispielsweise Alkohole. Die Säurestärke steigt, wenn in der Nähe der Carboxylgruppe (in α-, β- oder γ-Position) weitere elektronenziehende Gruppen vorhanden sind. Trifluoressigsäure oder Trichloressigsäure wirken stärker sauer als Milchsäure, die wiederum eine stärkere Säure als Essigsäure ist. Carbonsäuren mit 1–3 C-Atomen riechen stechend, sind ätzend für die menschliche Haut und sehr gut wasserlöslich. Carbonsäuren mit 4–9 C-Atomen riechen stark ranzig, wie das bekannteste Beispiel Buttersäure zeigt. Carbonsäuren mit 10 und mehr C-Atomen sind geruchlos und wachsartig fest (Fettsäuren).
Alkohole, Phenole, Enole
Unsubstituierte Alkohole besitzen eine sehr geringe Acidität, während Phenole und Naphthole durch die Mesomeriestabilisierung des entstehenden Phenolats leichter deprotonierbar sind: Phenol ist mit dem pKs-Wert von 9,9 um einen Faktor 100 stärker sauer als Alkanole wie etwa Ethanol (mit einem pKs von 16). Substituenten an den Verbindungen, welche einen -I- oder -M-Effekt ausüben, erhöhen ebenfalls die Säurestärke, indem sie die negative Ladung des entstehenden Anions stabilisieren.[1] Dies führt zu stark sauren Verbindungen wie Pikrinsäure (-M-Effekt) oder Pentachlorphenol (-I-Effekt). Bei einigen Substituenten wie Halogenatomen oder Nitrogruppen treten beide Effekte - teils sogar in unterschiedlicher Richtung - auf. Das Endiol Ascorbinsäure besitzt einen pKs von 4,2 und ist damit stärker sauer als Essigsäure (pKs 4,8).
Thiole
Hauptartikel: Alkanthiole
Thiole besitzen eine höhere Acidität als die entsprechenden Alkohole, die entstehenden Thiolate daher stabiler als die Alkololate. Dies zeigt der Vergleich der analogen Verbindungen Ethanol (pKs 16) und Ethanthiol (auch Ethylmercaptan, pKs 12).
Sulfonsäuren, Sulfonsäureester, Phosphosäureester
Die organischen Derivate und Hemiester von Mineralsäuren wie Schwefelsäure und Phosphorsäure besitzen eine der entsprechenden anorganischen Säure ähnliche Säurestärke. Der +I-Effekt langer Alkylketten stabilisiert dabei die entstehenden Anionen. Die Toluolsulfonsäure etwa besitzt einen pKs von 0,7, der Ester des Laurylalkohols mit der Schwefelsäure, Laurylsulfonsäure den Wert -0,09.
CH-acide Verbindungen
Hauptartikel: CH-Acidität
Auch Kohlenwasserstoffe ohne Carboxyl-, Hydroxyl- oder Sulfanylgruppe können aufgrund ihrer CH-Acidität als Säuren agieren. Hierbei ist das Vorkommen von Mehrfachbindungen und benachbarten funktionellen Gruppen oder Heteroatomen die Ursache der Acidität. Die bekannteste CH-acide Verbindung ist das Ethin (Acetylen), das aufgrund der Dreifachbindung einen pKs-Wert von 25 aufweist (Ethan: 50). Weitere Beispiele sind das Nitroethan (pKs 8,6) und das Nitrocyclopentadien, das stärker sauer ist (pKs 3,3) als Ameisensäure (3,75). Bei der Deprotonierung entsteht aus dem Nitrocyclopentadien ein Derivat des aromatischen Cyclopentadienyl-Anions. Auch hier bestimmen mesomere Effekte zusammen mit induktiven Effekten die Acidität der Verbindungen.
Übersicht
-
Stoffklasse acide funktionelle Gruppe Beispiel pKs-Wert bei 25 °C Carbonsäuren Carboxylgruppe: R–COOH  Essigsäure
Essigsäure4,8 Alkohole Hydroxylgruppe: R–OH  Ethanol
Ethanol16 Phenole Hydroxylgruppe : Ar-OH
(Ar=Aryl) Phenol
Phenol9,9 [2] Naphthole Hydroxylgruppe : Ar-OH
(Ar=Aryl)α-Naphthol 3,7 [2] Substituierte Phenole
(Substituenten mit -I-Effekt
wie Halogene, Nitrogruppe)Hydroxylgruppe : O2N-Ar-OH
(Ar=Aryl) Pikrinsäure
Pikrinsäure0,4 [2] Enole Hydroxylgruppe (Enol) : C=C-OH  Ascorbinsäure
Ascorbinsäure4,2 Thiole R–SH  Ethanthiol (C2H5-SH)
Ethanthiol (C2H5-SH)12 [3] Sulfate
(= Schwefelsäureester)R–O–SO3H Schwefelsäuredodecylester -0,09
Wert für die Säure[4]Sulfonsäuren R–SO3H CH3-SO3H Methansulfonsäure ? Sulfonsäuren R–SO3H
(Ar=Aryl)CH3-C6H4-SO3H Toluolsulfonsäure ~ 0,7 [5] Phosphate
(= Phosphorsäureester)R–O–PO2OH Adenosinmonophosphat ? CH-acide Verbindungen
AlkineH-C  C-R
C-R Ethin
Ethin25 CH-acide Verbindungen
NitroalkaneO2N-CRR'-H  Nitroethan
Nitroethan8,6 [6] CH-acide Verbindungen
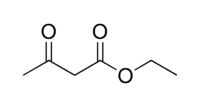
β-DicarbonyleRC=OCH2C=OR'  Acetylaceton
Acetylaceton≈ 9 [7] Anorganische Säuren zum Vergleich Mineralsäuren HO-SO2-OH  Schwefelsäure
Schwefelsäure-3
Einzelnachweise
- ↑ Alfons Hädener, Heinz Kaufmann: Grundlagen der organischen Chemie. Springer, 2006, ISBN 9783764370404
- ↑ a b c C. Lüders: Entwicklung von Analysenverfahren und Referenzmaterialien für die Bestimmung von Phenolen in umweltrelevanten Matrices, Dissertation an der Humboldt-Universität Berlin, 12.10.1999
- ↑ ChemieOnline Buchstabe E (Ethylmercaptan)
- ↑ P.H. Stahl, C.G. Wermuth: Handbook of Pharmaceutical Salts: Properties, Selection, and Use, 2002, Helvetica Chimica Acta, ISBN 3906390268
- ↑ ChemieOnline Buchstabe P
- ↑ ChemieOnline Buchstabe N
- ↑ ChemieOnline Buchstabe A
Wikimedia Foundation.