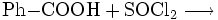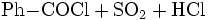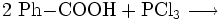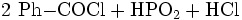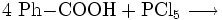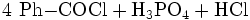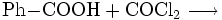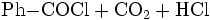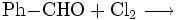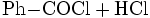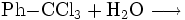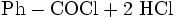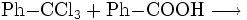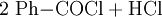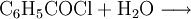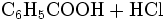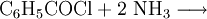- C6H5COCl
-
Strukturformel 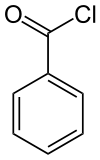
Allgemeines Name Benzoylchlorid Andere Namen - Benzoesäurechlorid
- Benzocarbonylchlorid
Summenformel C6H5COCl CAS-Nummer 98-88-4 Kurzbeschreibung farblose Flüssigkeit von stechendem Geruch Eigenschaften Molare Masse 140,57 g·mol−1 Aggregatzustand flüssig
Dichte 1,22 g·cm−3[1]
Schmelzpunkt Siedepunkt 197 °C[1]
Dampfdruck Löslichkeit Zersetzung in Wasser[1]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 
Ätzend (C) R- und S-Sätze R: 20/21/22-34-43 S: (1/2)-26-36/37/39-45 MAK nicht festgelegt, da Verdacht auf krebserzeugende Wirkung[1]
WGK 1[1] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Benzoylchlorid ist eine farblose, an feuchter Luft in Folge der Zersetzung zu Chlorwasserstoff und Benzoesäure, leicht rauchende Flüssigkeit. Formal ist es das Chlorid der Benzoesäure. Die unangenehm und stechend riechenden Dämpfe reizen Atemwege und Augen.
Inhaltsverzeichnis
Gewinnung und Darstellung
Benzoylchlorid lässt sich durch die Umsetzung von Benzoesäure mit Thionylchlorid (oder auch mit Phosphor(III)-chlorid und Phosphor(V)-chlorid, oder Phosgen) herstellen.
Wichtigste Methoden der industriellen Herstellung des Benzoylchlorids sind jedoch die Chlorierung von Benzaldehyd:
sowie die kontrollierte Hydrolyse von Benzotrichlorid:
oder dessen Reaktion mit Benzoesäure:
Eigenschaften
Benzoylchlorid ist eine schwer entzündliche Flüssigkeit (Flammpunkt zwischen 55 und 100 °C), deren Dämpfe mit Luft beim Erhitzen des Stoffes über seinen Flammpunkt ein explosionsfähiges Gemisch bilden können.
Chemische Eigenschaften
Benzoylchlorid reagiert mit Wasser in einer Hydrolysereaktion zu Benzoesäure und Salzsäure.
Durch Reaktion mit Ammoniak lässt sich Benzamid herstellen.Verwendung
Benzoylchlorid wird u. a. zur Herstellung von Benzoesäureestern verwendet. Wegen seiner Schwerlöslichkeit in Wasser kann die Veresterung gut nach der Schotten-Baumann-Methode durchgeführt werden. Die Verwendung von Carbonsäurechloriden anstelle der Carbonsäuren liefert deutlich höhere Ausbeuten.
Sicherheitshinweise
Beim Kontakt mit Wasser (z. B. aus der Luft) entstehen gefährliche Chlorwasserstoff-Dämpfe. Jeglicher Hautkontakt ist zu vermeiden, Benzoylchlorid verursacht schmerzhafte Verätzungen. Unbedingt vermieden werden sollte das Einatmen der Dämpfe. Im Tierversuch erwies sich Benzoylchlorid (wahrscheinlich wegen der extrem schnellen Metabolisierung zu Benzoesäure, Hippursäure und Chlorwasserstoff) nicht als genotoxisch. Aussagen zur Kanzerogenität können zur Zeit nicht getroffen werden [3]
Quellenangaben
- ↑ a b c d e f g Eintrag zu CAS-Nr. 98-88-4 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 07.01.2008 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 98-88-4 im European chemical Substances Information System ESIS
- ↑ BAUA [1]
Weblinks
Wikimedia Foundation.