- Ammoniumchromat
-
Strukturformel 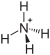
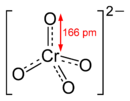
Allgemeines Name Ammoniumchromat Andere Namen - Ammoniummonochromat
Summenformel (NH4)2CrO4 CAS-Nummer 7788-98-9 PubChem 24595 Kurzbeschreibung gelbe, geruchlose Kristalle[1]
Eigenschaften Molare Masse 152,07 g·mol−1 Aggregatzustand fest
Dichte 1,8 g·cm−3[1]
Schmelzpunkt Löslichkeit gut in Wasser (340 g·l−1 bei 20°C)[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [1] 


Gefahr
H- und P-Sätze H: 350i-317-410 EUH: keine EUH-Sätze P: 220-261-273-342+311 [2] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 

Giftig Umwelt-
gefährlich(T) (N) R- und S-Sätze R: 49-43-50/53 S: 53-45-60-61 MAK keine MAK, da kanzerogen[4]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Ammoniumchromat ist das Ammoniumsalz der Chromsäure mit der Summenformel (NH4)2CrO4.
Inhaltsverzeichnis
Eigenschaften
Ammoniumchromat liegt in Form gelber, gut wasserlöslicher Kristalle vor, welche sich bei 185°C explosionsartig zu Ammoniak, Stickstoff, Chrom(III)-oxid und Wasser zersetzen[1]. Des Weiteren kann Ammoniumchromat, aufgrund seiner oxidierenden Eigenschaften, auf gefährliche Weise mit Reduktionsmitteln oder brennbaren Stoffen reagieren. Wässrige Lösungen reagieren neutral.
Verwendung
Ammoniumchromat findet Verwendung bei der Herstellung von Eisen-Chromoxid-Katalysatoren[5]. Außerdem kann Ammoniumchromat auch zur Darstellung von Bleichromat dienen.
Sicherheitshinweise
Aufgrund seines krebserzeugenden Potenzials ist beim Umgang mit Ammoniumchromat Vorsicht geboten. Hautkontakt kann zu Sensibilisierung führen. Bei der Handhabung ist daher entsprechende Schutzkleidung zu tragen.
Toxikologie und Ökotoxikologie
Ammoniumchromat ist toxikologisch von der EU-Kommission eingestuft als:
Krebserzeugend Kategorie: 1: (R49: Kann Krebs erzeugen beim Einatmen.)[1]
Mutagen Kategorie: 2: Keimzellmutagene, deren Wirkung anhand einer erhöhten Mutationsrate unter den Nachkommen exponierter Säugetiere nachgewiesen wurde[1].
Ökotoxikologisch ist Ammoniumchromat als WGK 3 (stark wassergefährdend) eingestuft.[1]
Gesetzliche Hinweise
Ammoniumchromat unterliegt der Chemikalienverbotsverordnung und dem Wasserhaushaltsgesetz. In industriellen Mengen unterliegt es außerdem der Störfallverordnung.
Einzelnachweise
- ↑ a b c d e f g h i Eintrag zu CAS-Nr. 7788-98-9 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 15.08.2007 (JavaScript erforderlich)
- ↑ Datenblatt Ammoniumchromat bei Sigma-Aldrich, abgerufen am 9. März 2011.
- ↑ Eintrag zu CAS-Nr. 7788-98-9 im European chemical Substances Information System ESIS
- ↑ "Grenzwerte am Arbeitsplatz", Maximale Arbeitsplatz-Konzentrationswerte (MAK-Werte), Biologische Arbeitsstoff-Toleranzwerte (BAT-Werte) und Grenzwerte für physikalische Einwirkungen. Periodisch publiziert von SUVA.ch. PDF-Datei 2011
- ↑ Patent-De
Kategorien:- Krebserzeugender Stoff
- Sensibilisierender Stoff
- Umweltgefährlicher Stoff
- Ammoniumverbindung
- Chromat
Wikimedia Foundation.
