- Cobalt(II)-acetat
-
Strukturformel 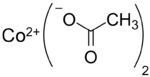
Allgemeines Name Cobalt(II)-acetat Andere Namen - Kobalt(II)-acetat
- Cobaltacetat
Summenformel C4H6CoO4 CAS-Nummer - 71-48-7 (wasserfrei)
- 6147-53-1 (Tetrahydrat)
PubChem 6277 Kurzbeschreibung Eigenschaften Molare Masse 177,02 g·mol−1 Aggregatzustand fest
Schmelzpunkt 140 °C[1]
Löslichkeit Sicherheitshinweise GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [3] 

Gefahr
H- und P-Sätze H: 350i-341-360F-334-317-410 EUH: keine EUH-Sätze P: 201-281-273-308+313-304+340-342+311 [1] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 

Giftig Umwelt-
gefährlich(T) (N) R- und S-Sätze R: 49-60-42/43-68-50/53 S: 53-45-60-61 LD50 503 mg·kg−1 (oral Ratte)[1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Cobalt(II)-acetat ist eine chemische Verbindung aus der Gruppe der Cobaltverbindungen und Acetate.
Inhaltsverzeichnis
Gewinnung und Darstellung
Die Herstellung von Cobalt(II)-acetat-tetrahydrat durch Reaktion von Cobalt(II)-oxid mit Essigsäure wurde erstmals 1777 erwähnt:[4]
Der Kristallwassergehalt wurde erstmals 1878 von H. Stallo bestimmt.[5] Die heute übliche Darstellungsmethode des Tetrahydrats ist die Reaktion von Cobalt(II)-carbonat mit Essigsäure.[6]
Wasserfreies Kobaltacetat kann durch Reaktion von Cobalt(II)-nitrat mit Essigsäureanhydrid hergestellt werden.[2]
Eigenschaften
Das Tetrahydrat kristallisiert im monoklinen Kristallsystem in der Raumgruppe P21/c mit den Gitterparametern a = 477,4 pm, b = 1184,3 pm, c = 829,0 pm und ß = 93,14°.[6][7] In der Elementarzelle befinden sich zwei Formeleinheiten.[8] Die Kristalle sind isomorph zum Nickel(II)-acetat.[8]
Es existiert weiters auch ein basisches Cobalt(II)-acetat mit der Zusammensetzung Co5(OH)2(CH3COO)8. Es kristallisiert als Dihydrat und entsteht bei der Zersetzung von Cobalt(III)-acetylacetonat.[6][9]
Mit Ammoniumchromat bildet Cobalt(II)-acetat ein Doppelsalz der Zusammensetzung (NH4)2Co(CrO4)2·6H2O, das in braungelben Prismen kristallisiert.[10]
Beim Erhitzen gibt Cobalt(II)-acetat-Tetrahydrat zunächst sein Kristallwasser ab. Die Dehydratisierung ist bei 150 °C abgeschlossen[11] und läuft in zwei Stufen ab – es bildet sich intermediär ein Hemihydrat Co(CH3COO)2 · 0.5 H2O.[12] Beim weiteren Erhitzen der wasserfreien Verbindung entsteht ein basisches Acetat mit der stöchiometrischen Zusammensetzung Co(OH)(CH3COO).[12][13] Als Endprodukt der Zersetzung entsteht in Wasserstoffatmosphäre elementares Cobalt, in Stickstoffatmosphäre Cobalt(II)-oxid und an der Luft Cobalt(II,III)-oxid Co3O4.[13]
Verwendung
Cobalt(II)-acetat wird als Bleich- und Trockenmittel für Lacke und Firnisse und als Katalysator bei der Herstellung von Adipinsäure verwendet.[1]
Einzelnachweise
- ↑ a b c d e f g Eintrag zu CAS-Nr. 71-48-7 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 11. November 2010 (JavaScript erforderlich)
- ↑ a b E. Späth: „Über die Einwirkung von Essigsäureanhydrid auf Nitrate“, in: Monatshefte für Chemie, 1912, 33 (3), S. 235–251; doi:10.1007/BF01519254; Volltext.
- ↑ a b Eintrag zu CAS-Nr. 71-48-7 im European chemical Substances Information System ESIS (ergänzender Eintrag)
- ↑ C. F. Wenzel: Lehre von der Verwandtschaft der Körper, Verlag Gerlach 1777, S. 194 (Volltext in der Google Buchsuche).
- ↑ F. W. Clarke: „Einige Bestimmungen specifischer Gewichte“, in: Berichte der Deutschen chemischen Gesellschaft, 1878, 11 (2), S. 1504–1507; doi:10.1002/cber.18780110261; Volltext bei gallica.
- ↑ a b c J. Matthes: Kristalline Cobalt(II)-carboxylate aus der Gasphase, Universität Bonn, Dissertation 2009, S. 7–8; Volltext.
- ↑ A. N. Sobolev, E. B. Miminoshvili, K. E. Miminoshvili, T. N. Sakvarelidze: „Cobalt diacetate tetrahydrate“, in: Acta Cryst., 2003, E59 (10), m836–m837; doi:10.1107/S1600536803019093.
- ↑ a b J. N. Van Niekerk, F. R. L. Schoening: „The crystal structures of nickel acetate, Ni(CH3COO)2·4H2O, and cobalt acetate, Co(CH3COO)2·4H2O“, in: Acta Crystallographica, 1953, 6 (7), S. 609–612; doi:10.1107/S0365110X5300171X.
- ↑ R. Kuhlman, G. L. Schimek, J. W. Kolis: „An Extended Solid from the Solvothermal Decomposition of Co(Acac)3: Structure and Characterization of Co5(OH)2(O2CCH3)8·2H2O“, in: Inorg. Chem., 1999, 38 (1), S. 194–196; doi:10.1021/ic9802855.
- ↑ R. Abegg, F. Auerbach: Handbuch der anorganischen Chemie, Bd. 4, S. Hirzel Verlag, 1921, S. 400; Volltext.
- ↑ R. W. Grimes, A. N. Fitch: „Thermal decomposition of cobalt(II) acetate tetrahydrate studied with time-resolved neutron diffraction and thermogravimetric analysis“, in: Journal of Materials Chemistry, 1991, 1, S. 461–468; doi:10.1039/JM9910100461.
- ↑ a b T. Wanjun, C. Donghua: „Mechanism of thermal decomposition of cobalt acetate tetrahydrate“, in: Chemical Papers, 2007, 61 (4), S. 329–332; doi:10.2478/s11696-007-0042-3.
- ↑ a b M. A. Mohamed, S. A. Halawy, M. M. Ebrahim: „The non-isothermal decomposition of cobalt acetate tetrahydrate. A kinetic and thermodynamic study“, in: Journal of Thermal Analysis and Calorimetry, 1994, 41, S. 387–404; doi:10.1007/BF02549322.
Kategorien:- Krebserzeugender Stoff
- Stoff mit reproduktionstoxischer Wirkung
- Sensibilisierender Stoff
- Umweltgefährlicher Stoff
- Cobaltverbindung
- Acetat
Wikimedia Foundation.


