- Ammoniumhydrogensulfid
-
Strukturformel 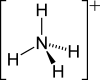
Allgemeines Name Ammoniumhydrogensulfid Andere Namen - Ammoniumbisulfid
- Ammoniummercaptan
Summenformel H5NS CAS-Nummer 12124-99-1 PubChem 25515 Kurzbeschreibung hygroskopisches, farbloses Pulver mit charakteristischem Geruch[1]
Eigenschaften Molare Masse 51,1 g·mol−1 Aggregatzustand fest
Dichte 1,17 g·cm−3[2]
Dampfdruck Löslichkeit Brechungsindex 1,72[2]
Sicherheitshinweise EU-Gefahrstoffkennzeichnung [4] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Thermodynamische Eigenschaften ΔHf0 −37,5 kJ/mol[3]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C Ammoniumhydrogensulfid ist eine chemische Verbindung aus der Gruppe der Ammoniumsalze und Hydrogensulfide.
Inhaltsverzeichnis
Gewinnung und Darstellung
Lösungen von Ammoniumhydrogensulfid können hergestellt werden, indem man Schwefelwasserstoffgas durch konzentriertes Ammoniak leitet.
Eigenschaften
Ammoniumhydrogensulfid ist ein instabiles, hygroskopisches, farbloses Pulver mit charakteristischem Geruch. Es bildet orthorhombische oder tetraederförmige Kristalle mit der Kristallstruktur P4/nmm.[2] Kommerziell ist es als 40%ige Lösung verfügbar, da diese stabiler ist als der Feststoff. Die Verbindung zerfällt leicht zu Ammoniak und Schwefelwasserstoff, was ihren charakteristischen Geruch ausmacht. Beim Erhitzen zersetzt sich Ammoniumhydrogensulfid, wobei nitrose Gase, Schwefelwasserstoff, Ammoniak und Sulfide entstehen.[5]
Mit Schwefel reagiert die Verbindung zu Diammoniumtrisulfid (einem Ammoniumpolysulfid).[3]
Verwendung
Ammoniumhydrogensulfid wurde aufgrund seines Geruchs in Stinkbomben verwendet, ist jedoch offiziell nach Richtlinie 76/769/EWG Stand - September 2007 nicht zugelassen in Scherzartikeln und Gegenständen, die als solche verwendet werden können, wie z.B. Niespulver und Stinkbomben.[5]
Einzelnachweise
- ↑ a b c International Chemical Safety Cards
- ↑ a b c Jean DAns, Ellen Lax; Elemente, anorganische Verbindungen und Materialien, Minerale: Bd. III; ISBN 978-3-540-60035-0
- ↑ a b c d Patnaik; Handbook of Inorganic Chemical Compounds; ISBN 978-0-07-049439-8
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b Eintrag zu CAS-Nr. 12124-99-1 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 21. Januar 2010 (JavaScript erforderlich)
Kategorien:- Ammoniumverbindung
- Sulfid
Wikimedia Foundation.


