- Cadmiumcarbonat
-
Strukturformel 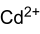
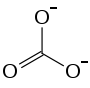
Allgemeines Name Cadmiumcarbonat Andere Namen Kadmiumkarbonat
Summenformel CCdO3 CAS-Nummer 513-78-0 PubChem 10564 Kurzbeschreibung weißer geruchloser Feststoff[1]
Eigenschaften Molare Masse 172,42 g·mol−1 Aggregatzustand fest
Dichte 4,26 g·cm−3[1]
Schmelzpunkt 357 °C (Zersetzung)[1]
Löslichkeit Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [1] 

Achtung
H- und P-Sätze H: 302-312-332-410 EUH: keine EUH-Sätze P: 261-280-302+352-304+340-322-501 [1] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [4] 

Gesundheits-
schädlichUmwelt-
gefährlich(Xn) (N) R- und S-Sätze R: 20/21/22-50-53 S: 60-61 LD50 438 mg·kg−1 (oral Ratte)[1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Cadmiumcarbonat ist eine chemische Verbindung aus der Gruppe der Carbonate.
Inhaltsverzeichnis
Vorkommen
Cadmiumcarbonat kommt natürlich in Form des Minerals Otavit und als Zink-Cadmium-carbonat Cadmiumsmithsonit (Zn,Cd)CO3 vor.[5]
Gewinnung und Darstellung
Cadmiumcarbonat kann durch Reaktion einer Cadmiumchlorid-Lösung mit Ammoniumcarbonat und anschließende Auflösung des entstehenden Niederschlags mit Ammoniak.[2]
Cadmiumcarbonat kann auch durch Reaktion einer Cadmiumchlorid-Lösung mit konzentrierter Salzsäure und Harnstoff gewonnen werden.[2]
Eigenschaften
Cadmiumcarbonat ist ein nicht brennbarer, weißer geruchloser Feststoff der sich bei Temperaturen größer als 357 °C zersetzt wobei Cadmiumoxid und Kohlendioxid entstehen.[1] Es besitzt eine hexagonale Kristallstruktur des Calcit-Typs mit der Raumgruppe
 (a = 4,920, c = 16,298 Å).[2]
(a = 4,920, c = 16,298 Å).[2]Verwendung
Cadmiumcarbonat wird zur Herstellung von Cadmiumoxid und anderen Cadmiumsalzen (wie den Pigmenten Cadmiumgelb und Cadmiumrot) verwendet.[3]
Einzelnachweise
- ↑ a b c d e f g h Eintrag zu CAS-Nr. 513-78-0 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 25. September 2010 (JavaScript erforderlich)
- ↑ a b c d Georg Brauer: Handbuch der Präparativen Anorganischen Chemie Band II; ISBN 3-432-87813-3
- ↑ a b Cadmiumcarbonat (Todini and Co)
- ↑ Nicht explizit in RL 67/548/EWG, Anh. I gelistet, fällt aber dort mit der angegebenen Kennzeichnung unter den Sammelbegriff „Cadmiumverbindungen“; Eintrag in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Oktober 2010 (JavaScript erforderlich)
- ↑ Otavit (Mineralienatlas)
Wikimedia Foundation.

![\mathrm{CdCl_2 + (NH_4)_2CO_3 + NH_3 \longrightarrow [Cd(NH_3)_4]CO_3 + NH_4Cl}](9/cf9aa469c62ca5072e33f0081cb6e370.png)
![\mathrm{[Cd(NH_3)_4]CO_3 \longrightarrow CdCO_3 + 4 \ NH_3}](e/47e51c072b2b68016564c1caf2663c9a.png)
