- Quecksilber(I)-nitrat
-
Strukturformel 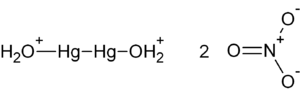
Allgemeines Name Quecksilber(I)-nitrat Summenformel - Hg2(NO3)2
- Hg2(NO3)2 · 2 H2O (Dihydrat)
CAS-Nummer - 10415-75-5 (wasserfrei)
- 14836-60-3 (Dihydrat)
Eigenschaften Molare Masse 525,19 g·mol−1 Aggregatzustand fest
Dichte 4,79 g·cm−3(Dihydrat)[1]
Schmelzpunkt Zersetzung ab 70 °C [2]
Löslichkeit sehr gut löslich in Wasser [2]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [3] 


Gefahr
H- und P-Sätze H: 300-310-330-373-410 EUH: keine EUH-Sätze P: 260-264-273-280-284-301+310 [3] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [4] 

Sehr giftig Umwelt-
gefährlich(T+) (N) R- und S-Sätze R: 26/27/28-33-50/53 S: 13-28-36-45-60-61 LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Quecksilber(I)-nitrat ist ein Salz des einwertigen Quecksilbers und der Salpetersäure mit der Summenformel Hg2(NO3)2.
Inhaltsverzeichnis
Darstellung
Quecksilber(I)-nitrat kann als Dihydrat durch Auflösen von elementarem Quecksilber in kalter, verdünnter Salpetersäure und Kristallisation des Salzes durch vorsichtiges Einengen dargestellt werden:[7]
Eigenschaften und Struktur
Das hochtoxische, feste Nitrat löst sich gut in Wasser. Beim Auskristallisieren aus wässrigen Lösungen scheidet sich das Dihydrat Hg2(NO3)2 · 2 H2O in farblosen, monoklinen Kristallen ab. Das Kristallgitter des Dihydrats setzt sich aus linearen [H2O-Hg-Hg-OH2]2+-Kationen mit einem Hg-Hg-Abstand von 254 pm und daran koordinierten Nitratanionen zusammen.[1] Auch die wasserfreie Verbindung besteht aus Dimeren mit einer linearen Hg-Hg-Bindung.
Aufgrund der geringen Stabilität von Quecksilber(I)-Verbindungen disproportioniert das Nitrat im Licht und bei Temperaturerhöhung unter Dunkelfärbung zu elementarem Quecksilber und Quecksilber(II)-nitrat.
Verwendung
Quecksilber(I)-nitrat wird als Reagenz, zur Feuervergoldung, zum Schwärzen von Messing und zur Darstellung weiterer Quecksilber(I)-Verbindungen eingesetzt.[7]
Sicherheitshinweise
Wegen der sehr guten Wasserlöslichkeit ist eine Aufnahme über Haut, Schleimhäute, Atemwege und den Verdauungstrakt möglich. Im Magen wird Quecksilber(I)-nitrat zum nahezu unlöslichen Quecksilber(I)-chlorid umgesetzt. Toxikologische Untersuchungen zum Menschen liegen für Quecksilber(I)-nitrat nicht vor. Bei Tieren wie der Maus (5 mg·kg−1 intraperitoneal[5], 49,3 mg·kg−1 oral[6]) und der Ratte (170 mg·kg−1 oral) war die Giftigkeit hoch. Bei beiden Spezies traten als Vergiftungssymptome gastrointestinale Störungen wie Durchfall auf.[2]
Einzelnachweise
- ↑ a b Wissenschaft-Online-Lexika: Eintrag zu Quecksilbernitrate im Lexikon der Chemie. Abgerufen am 26. Juni 2009
- ↑ a b c Eintrag zu CAS-Nr. 10415-75-5 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 26. Juni 2009 (JavaScript erforderlich)
- ↑ a b Datenblatt Mercury(I) nitrate dihydrate bei Sigma-Aldrich, abgerufen am 22. April 2011.
- ↑ Nicht explizit in RL 67/548/EWG, Anh. I gelistet, fällt aber dort mit der angegebenen Kennzeichnung unter den Sammelbegriff „Anorganische Quecksilberverbindungen“; Eintrag in der GESTIS-Stoffdatenbank des IFA, abgerufen am 26. Juni 2009 (JavaScript erforderlich)
- ↑ a b Archiv fuer Toxikologie. Vol. 20, Pg. 226, 1964.
- ↑ a b c Gigiena i Sanitariya. For English translation, see HYSAAV. Vol. 46(8), Pg. 12, 1981.
- ↑ a b Franz v. Bruchhausen, Hermann Hager: Hagers Handbuch der pharmazeutischen Praxis. 5. Auflage, Bd. 9 Stoffe P–Z, Birkhäuser, 1999, ISBN 9783540526889, S. 474—475
Kategorien:- Giftiger Stoff
- Umweltgefährlicher Stoff
- Quecksilberverbindung
- Nitrat
Wikimedia Foundation.


