- Hydroxylammoniumnitrat
-
Strukturformel 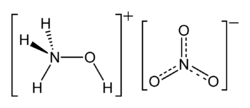
Allgemeines Name Hydroxylammoniumnitrat Andere Namen - Hydroxylaminnitrat
- HAN
Summenformel H4N2O4 CAS-Nummer 13465-08-2 PubChem 26045 Kurzbeschreibung Feststoff[1]
Eigenschaften Molare Masse 96,05 g·mol−1 Aggregatzustand fest
Dichte 1,841 g·cm−3[2]
Schmelzpunkt Löslichkeit löslich in Wasser[3]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [1] 



Gefahr
H- und P-Sätze H: 201-351-311-302-373-319-315-317-400 EUH: keine EUH-Sätze P: 273-280-305+351+338 [3] EU-Gefahrstoffkennzeichnung [1] 


Explosions-
gefährlichGiftig Umwelt-
gefährlich(E) (T) (N) R- und S-Sätze R: 2-22-24-36/38-40-43-48/22-50 S: (1/2)-26-36/37-45-61 LD50 882 mg·kg−1 (Ratte, oral)[4]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Hydroxylammoniumnitrat ist eine chemische Verbindung aus der Gruppe der Nitrate und ein Salz von Hydroxylamin.
Inhaltsverzeichnis
Gewinnung und Darstellung
Hydroxylammoniumnitrat kann durch Reaktion von Hydroxylammoniumsalzen wie Hydroxylammoniumsulfat oder Hydroxylammoniumchlorid mit Nitraten wie Bariumnitrat, Natriumnitrat, Kaliumnitrat oder Calciumnitrat gewonnen werden.[5] Es kann auch durch Elektrosynthese aus Salpetersäure gewonnen werden.[6]
Eigenschaften
Hydroxylammoniumnitrat ist ein Feststoff mit monokliner Kristallstruktur.[2] Er zersetzt sich bei Erhitzung über 100 °C explosionsartig, wobei Wasser, Sauerstoff, Stickstoff und geringe Mengen Stickstoffmonoxid entstehen.[1] Aus diesem Grund wird er als Einkomponenten-Treibstoff für Raketen und Granaten untersucht.[7] Das technische Produkt wird in Lösung mit Wasser in den Handel gebracht.[3] Es wurde auch als Reduktionsmittel in der Plutonium-Uran-Trennung und Plutonium-Rückextraktion verwendet.[8]
Einzelnachweise
- ↑ a b c d e Eintrag zu CAS-Nr. 13465-08-2 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 30. Dezember 2010 (JavaScript erforderlich)
- ↑ a b A. L. Rheingold, J. T. Cronin, T. B. Brill and F. K. Ross: Structure of hydroxylammonium nitrate (HAN) and the deuterium homolog. In: Acta Crystallographica Section C. 43, Nr. 3, März 1987, S. 402–404. doi:10.1107/S0108270187095593.
- ↑ a b c Datenblatt Hydroxylammoniumnitrat bei Sigma-Aldrich, abgerufen am 30. Dezember 2010.
- ↑ Toxikologische Bewertung von Hydroxylamin und seinen Salzen
- ↑ Freepatentsonline: Hydroxylammonium nitrate process
- ↑ Ralph E. White; Modern Aspects of Electrochemistry; ISBN 978-1-4419-0654-0
- ↑ Fraunhofer-Gesellschaft: Investigation of the combustion of liquid gun propellants in closed chambers
- ↑ Naturwissenschaftliche Rundschau, Band 36, S.313
Weblinks
- C. S. Choi, J. Schroeder, Y. T. Lee, J. Frankel and J. F. Cox; Thermodynamic properties of aqueous solutions of ammonium Nitrate salts, DOI: 10.1007/BF01912798
Kategorien:- Stoff mit Verdacht auf krebserzeugende Wirkung
- Giftiger Stoff
- Gesundheitsschädlicher Stoff
- Sensibilisierender Stoff
- Explosionsgefährlicher Stoff
- Umweltgefährlicher Stoff
- Nitrat
- N-Hydroxy-Verbindung
Wikimedia Foundation.
