- Levo-Alpha-Acetyl-Methadon
-
Strukturformel 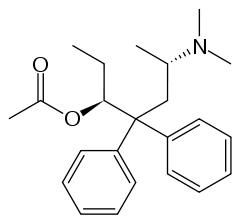
Allgemeines Freiname Levacetylmethadol Andere Namen Summenformel C23H31NO2 CAS-Nummer - 1477-40-3 ((S,S)-(–)-Acetylmethadol)
- 43033-72-3 ((S,S)-(–)-Acetylmethadol·Hydrochlorid)
PubChem 15130 ATC-Code N07BC03
DrugBank DB01227 Arzneistoffangaben Wirkstoffklasse Eigenschaften Molare Masse 353,50 g·mol−1 Schmelzpunkt Sicherheitshinweise Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln GHS-Gefahrstoffkennzeichnung [2] 
Gefahr
H- und P-Sätze H: 300-315-319-335-413 EUH: keine EUH-Sätze P: 261-264-301+310-305+351+338 [2] EU-Gefahrstoffkennzeichnung [2]
T
GiftigR- und S-Sätze R: 25-36/37/38 S: 26-45 LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Levo-Alpha-Acetyl-Methadon (LAAM) ist ein Opioid, das seit 2003 nicht mehr vermarktet wird, obwohl sich zwischenzeitlich gezeigt hat, dass es in der Behandlung der Opiatabhängigkeit (Drogensubstitution) Methadon und Buprenorphin überlegen sein könnte.[4]
Nachdem Wirkdauer bzw. Halbwertszeit dreimal so lang wie die des Methadons sind, muss es nur drei Mal pro Woche eingenommen werden. LAAM wird in der Leber zu nor-LAAM und dinor-LAAM verstoffwechselt, die beide ebenfalls wirksam sind und zur langen Wirkdauer beitragen. Vertrieben wird die Substanz in den USA durch die Roxane Laboratories in Columbus (Ohio), einem Tochterunternehmen der Boehringer Ingelheim. 2003 wurde die Anzahl der in den USA substituierten Patienten auf 5100 geschätzt.[5]
Levomethadon ist keine Kurzbezeichnung für LAAM, sondern die linksdrehende Form (das L-Enantiomer) des razemischen Methadons.
Die Zulassung der FDA wurde am 20. Juli 1993 erteilt. 2001 wurde dem Beipackzettel von der FDA eine „Black-Box-Warnung“ aufgrund der Möglichkeit von Torsade de pointes-Arrhythmien (10 Episoden bei insgesamt 33.000 behandelten Patienten) verordnet und in der Folge 2003 die Vermarktung von den Roxane Laboratories ausgesetzt.[6] Das Medikament ist in den USA immer noch zur Behandlung einer Opioid-Abhängigkeit zugelassen.[7] Aufgrund der möglichen kardialen Nebenwirkungen wird das Medikament in der EU derzeit nicht vermarktet. Die Autoren einer europäischen Multicenterstudie kommen jedoch zu dem Schluss, dass eine Diskussion bezüglich einer Einführung von LAAM in der EU stattfinden sollte. [8] Eine 2009 veröffentlichte Cochrane-Studie konnte keine Bewertung abgeben, da nur zwei Arbeiten den geforderten strengen Kriterien entsprachen. [9]
Einzelnachweise
- ↑ Thieme Chemistry (Hrsg.): RÖMPP Online – Version 3.6. Georg Thieme Verlag KG, Stuttgart 2009.
- ↑ a b c Datenblatt LAAM hydrochloride bei Sigma-Aldrich, abgerufen am 7. April 2011.
- ↑ a b c Levo-Alpha-Acetyl-Methadon bei ChemIDplus.
- ↑ „Pharmacotherapies for the Treatment of Opioid Dependence: Efficacy, Cost-Effectiveness and Implementation Guidelines“. Richard P. Mattick, et al.; Informa, 2009.
- ↑ Frank Vocci, Ph.D.: Medications Development Update; May 22, 2003.
- ↑ The FDA Safety Information and Adverse Event Reporting Program.
- ↑ APA Practice Guidelines > Substance Use Disorders: Treatment of Patients With Substance Use Disorders, Second Edition DOI: 10.1176/appi.books.9780890423363.141077.
- ↑ Clark NC, Lintzeris N, Gijsbers A, Whelan G, Dunlop A, Ritter A, Ling WW: A randomized, open-label trial comparing methadone and Levo-Alpha-Acetylmethadol (LAAM) in maintenance treatment of opioid addiction. Pharmacopsychiatry. 2009 Jan;42(1):1-8. Epub 2009 Jan 19, PMID: 19153939.
- ↑ Minozzi S, Amato L, Davoli M.: Maintenance treatments for opiate dependent adolescent. Cochrane Database Syst Rev. 2009 Apr 15;(2):CD007210, PMID: 19370679.
Weblinks

Bitte den Hinweis zu Gesundheitsthemen beachten! Kategorien:- ATC-N07
- Giftiger Stoff
- Arzneistoff
- Opioid
- Synthetische Droge
- Entwöhnungsmittel
- Carbonsäureester
- Aromat
- Amin
Wikimedia Foundation.
