- Chemiosmotisches Potential
-
Die chemiosmotische Kopplung ist, neben der Substratkettenphosphorylierung ein Weg zur Synthese von ATP aus ADP + Pi in lebenden Zellen. Dazu wird die osmotische Energie eines Protonen- bzw. Natriumgradienten genutzt. Diese Kopplung wird auch als chemiosmotische Hypothese bezeichnet, auch bekannt als Mitchell-Hypothese. Sie wurde erstmals 1961 von Peter Mitchell[1] aufgestellt. 1978 wurde Mitchell für die Entdeckung der chemiosmotischen Kopplung mit dem Nobelpreis für Chemie ausgezeichnet.[2][3]
Inhaltsverzeichnis
Grundprinzip
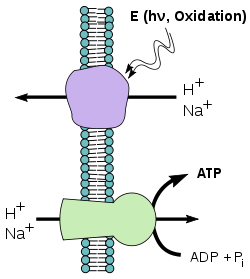
Durch die Aktivität von Protonenpumpen werden auf beiden Seiten einer Biomembran unterschiedliche pH-Werte aufgebaut. Es können aber auch Natriumionen transloziert werden. Dieser Vorgang benötigt Energie, da der Transport entgegen ein Konzentrationsgefälle erfolgt und die Membran dadurch energetisiert wird (ΔΨ). Das Transmembranprotein ATP-Synthase nutzt den Rücktransport von Protonen bzw. Natriumionen entlang dieses Konzentrationsgefälles zur Synthese des zellulären Energieträgers ATP aus ADP.
Die Energie zum Aufbau des Gradienten stammt entweder aus der Differenz der Redoxpotentiale bei der Oxidation energiereicher Stoffe (oxidative Phosphorylierung) oder aus der Lichtenergie (Photophosphorylierung).
Beispiele Organismus oder Organell Außen Innen Energiequelle Gram-negative Bakterien Periplasma Cytoplasma Redoxpotential Halobakterien Extrazellularraum Cytoplasma Licht Purpurbakterien Periplasma Cytoplasma Redoxpotential/Licht Chloroplasten Thylakoid-Innenraum Stroma Redoxpotential/Licht Mitochondrien Intermembranraum Matrix Redoxpotential Oxidative Phosphorylierung
In der Atmungskette der Mitochondrien können mehrere Proteinkomplexe als Protonentransporter fungieren: Dies sind neben der NADH-Dehydrogenase (Komplex I), die Cytochrom c Reduktase (Komplex III) (über den Q-Zyklus), sowie die Cytochrom c Oxidase (Komplex IV). Die Energie stammt aus der hohen Redoxpotentialdifferenz vom NADH bzw. FADH2 zum Sauerstoff. Eine Verstärkung des Gradienten erfolgt durch den Verbrauch von Protonen bei der Bildung von Wasser aus Sauerstoff und Protonen durch die Cytochrom c Oxidase.
Photophosphorylierung
Bei der oxygenen Photosynthese von grünen Pflanzen und Cyanobakterien fungiert das Cytochrom b6/f (Cyt b6/f) der Redoxkette als Protonenpumpe.
- Die Energie stammt zunächst aus dem Redoxpotential der Elektronen, die bei der acyclischen ATP-Bildung vom Photosystem II (PS II) zum Photosystem I (PS I) durch die Redoxkette transportiert werden. Die Energie der Elektronen stammt aus der Anregung durch das Licht im Photosystem II.
- Bei der cyclischen Phosphorylierung werden Elektronen im Photosystem I durch Licht angeregt und über Ferredoxin zurück auf das Cytochrom b6 übertragen.
Der Protonengradient wird dadurch verstärkt, dass auf der Seite des Thylakoid-Innenraums die Spaltung des Wassers zu Sauerstoff und Protonen erfolgt, also die Protonenkonzentation zusätzlich erhöht wird. Auf der Seite des Stromas wird NADPH unter Verbrauch von Protonen gebildet.
Auch bei der anoxygenen Photosynthese wird durch ein Photosystem eine Protonengradient durch Lichtenergie aufgebaut. Schließlich können auch Haloarchaea (z. B. Halobacterium salinarum) die Lichtenergie durch Bacteriorhodopsin direkt nutzen, um einen Protonegradienten aufzubauen.[4]
Quellen
- ↑ Mitchell, P. (1961): Coupling of phosphorylation to electron and hydrogen transfer by a chemi-osmotic type of mechanism. In: Nature 191, S. 144–148. PMID 13771349; doi:10.1038/191144a0
- ↑ Informationen der Nobelstiftung zur Preisverleihung 1978 an Peter Mitchell (englisch)
- ↑ Mitchell, P. (1979): David Keilins Konzept der Atmungskette und dessen chemiosmotische Konsequenzen (Nobel-Vortrag). In: Angewandte Chemie. Bd 91, S. 718–733. doi:10.1002/ange.19790910907
- ↑ Katharina Munk (Hrsg.): Taschenlehrbuch Biologie: Mikrobiologie. Thieme Verlag Stuttgart 2008, ISBN 978-3-13-144861-3, S. 346f.
Wikimedia Foundation.