- Phenanthridin
-
Strukturformel 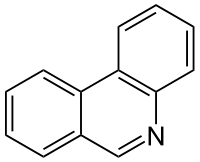
Allgemeines Name Phenanthridin Andere Namen - Benzo[c]quinoline
- 3,4-Benzoquinolin
Summenformel C13H9N CAS-Nummer 229-87-8 PubChem 9189 Kurzbeschreibung hellbrauner kristalliner Feststoff[1]
Eigenschaften Molare Masse 179,22 g·mol−1 Aggregatzustand fest
Schmelzpunkt Siedepunkt Löslichkeit löslich in Methanol[2]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [1] 

Gefahr
H- und P-Sätze H: 301-315-318-335 EUH: keine EUH-Sätze P: 261-280-301+310-305+351+338 [1] EU-Gefahrstoffkennzeichnung [1] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 22-37/38-41 S: 26-39 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Phenanthridin ist eine chemische Verbindung aus der Gruppe der stickstoffhaltigen Heterocyclen.
Inhaltsverzeichnis
Gewinnung und Darstellung
Phenanthridin wurde 1889 zuerst von Amé Jules Pictet und H. J. Ankersmit aus Benzalanilin durch Pyrolyse im Glührohr synthetisiert.[3] Seine Derivate kommen natürlich in Amaryllidoideae vor.
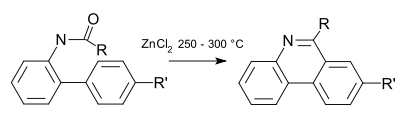
Bei der Pictet-Hubert-Reaktion (1899) entsteht die Verbindung bei der Reaktion eines 2-Aminobiphenyl-Formaldehyd-Adduktes (ein N-Acyl-o-xenylamin) mit Zinkchlorid bei erhöhten Temperaturen.[4] Die Reaktionsbedingungen wurden durch Morgan und Walls 1931 durch Ersatz des Metalles durch Phosphoroxychlorid und Verwendung von Nitrobenzen als Lösungsmittel verwendet.[5] Aus diesem Grund wird die Reaktion auch Morgan-Walls-Reaktion genannt.[6]
Die Reaktion ist ähnlich zur Bischler-Napieralski-Reaktion und der Pictet-Spengler-Reaktion.
Auch die Herstellung beginnend mit Phenanthrachinon, N-Methylcarbazol, Fluorenonoxim oder Phenanthridonen ist möglich.[7]
Eigenschaften
Phenanthridin ist ein hellbrauner kristalliner Feststoff. [1] Phenanthridin und seine Derivate sind tertiäre Basen und bilden mit Säuren Monosäuresalze.[8]
Verwendung
Phenanthridin stellt die Grundstruktur einiger Alkaloide (z.B. Fagaronin, genauer Hydrobenzo[c]-Phenanthridine), Arzneistoffe (z.B. Isometamidium) und anderer chemischer Verbindungen (z.B. Ethidiumbromid) dar.
Weblinks
- Kerstin Schulte: Synthese von Phenanthridin- und Benzo(c)phenanthridin-Derivaten und Untersuchungen auf ihre biologische Wirkung
Einzelnachweise
- ↑ a b c d e f g Datenblatt Phenanthridin bei Sigma-Aldrich, abgerufen am 18. Januar 2011.
- ↑ Datenblatt Phenanthridin bei TCI Europe, abgerufen am 27. Juni 2011.
- ↑ Mittheilung Ueber das Phenanthridin Amé Pictet, H. J. Ankersmit Chemisches Laboratorium der Universität Genf Justus Liebigs Annalen der Chemie Volume 266 Issue 1-2, Pages 138 - 153 doi:10.1002/jlac.18912660107
- ↑ Mittheilungen Ueber eine neue Synthese der Phenanthridinbasen Amé Pictet, A. Hubert Berichte der deutschen chemischen Gesellschaft Volume 29 Issue 2, S. 1182–1189, 1896 doi:10.1002/cber.18960290206
- ↑ CCCXXXV.—Researches in the phenanthridine series. Part I. A new synthesis of phenanthridine homologues and derivatives Gilbert T. Morgan, Leslie Percy Walls, J. Chem. Soc., 1931, 2447-2456 doi:10.1039/JR9310002447
- ↑ Name reactions in heterocyclic chemistry, Jie Jack Li
- ↑ C. F. Allen,Lindsey Allen,Allen, Richard; The Chemistry of Heterocyclic Compounds, Six Membered Heterocyclic Nitrogen; ISBN 978-0-470-37851-9.
- ↑ Raj K. Bansal; Heterocyclic Chemistry; ISBN 81-224-1212-2.
Kategorien:- Giftiger Stoff
- Gesundheitsschädlicher Stoff
- Stickstoffhaltiger Heterocyclus
Wikimedia Foundation.