- Chlorid nach Mohr
-
Die Titration nach Mohr ist eine Methode zur quantitativen Bestimmung von Chlorid- und Bromidionen. Sie wird zur Argentometrie gezählt. Benannt ist die Methode nach dem deutschen Pharmazeuten Karl Friedrich Mohr .
Inhaltsverzeichnis
Titration
Bei dieser Titration wird die chlorid- oder bromidhaltige Lösung direkt mit Silbernitrat-Maßlösung titriert. Als Indikator wird dabei Kaliumchromat verwendet. Am Äquivalenzpunkt wird dabei Silberchromat gebildet. Dieses ist schwerlöslich und im Gegensatz zum ebenfalls schwerlöslichen Silberchlorid rotbraun.
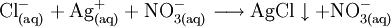
- Bis zum Äquivalenzpunkt fällt bei Zugabe von Silbernitratlösung weißes Silberchlorid aus.
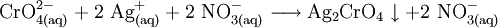
- Ab dem Äquivalenzpunkt bildet sich schwerlösliches Silberchromat, das als rotbrauner Niederschlag ausfällt.
Bedingungen
Bei dieser Titration ist es wichtig einen pH-Wert zwischen 6,5 und 7,2 einzuhalten, da sonst verfälschte Ergebnisse erhalten werden. Dies wird meist mit Essigsäure oder Natriumhydrogencarbonat-Lösung erreicht. Ist die Lösung zu sauer, so liegt das Kaliumchromat vorwiegend als Dichromat vor, der Farbumschlag erfolgt zu spät. Im basischen Bereich fällt schwerlösliches Silber(I)-oxid aus, das ebenfalls die Ergebnisse verfälscht. Iodid kann nicht nach Mohr titriert werden, weil Silberiodid zu schwer löslich ist. Dadurch reicht die Silberionenkonzentration am Äquivalenzpunkt nicht aus, um das Löslichkeitsprodukt des Silberchromats zu überschreiten. Letzteres würde daher nicht ausfallen.
Sonstiges
Dieses Nachweisverfahren wird im Österreichischen Arzneibuch (ÖAB) angewendet.
Andere Nachweisverfahren für Halogenidionen sind die Titration nach Fajans und die Titration nach Volhard.
Quellen
- Jander, Blasius: Einführung in das anorganisch-chemische Praktikum. 14. Auflage. S. Hirzel Verlag, Stuttgart, Leipzig 1995, ISBN 3777606723
Wikimedia Foundation.
