- Rubidiumformiat
-
Strukturformel 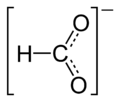
Allgemeines Name Rubidiumformiat Andere Namen Rubidiummethanoat
Summenformel CHO2Rb CAS-Nummer 3495-35-0 PubChem 23673641 Kurzbeschreibung weißes Pulver[1]
Eigenschaften Molare Masse 130,48 g·mol−1 Aggregatzustand fest[1]
Schmelzpunkt Löslichkeit löslich in Wasser[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [3] 
Achtung
H- und P-Sätze H: 315-319-335 EUH: keine EUH-Sätze P: 261-305+351+338 [3] EU-Gefahrstoffkennzeichnung [1] 
Reizend (Xi) R- und S-Sätze R: 36/37/38 S: 26-37 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Rubidiumformiat ist das Rubidiumsalz der Ameisensäure.
Gewinnung und Darstellung
Rubidiumformiat kann durch Salzbildungsreaktion aus Rubidiumhydroxid und Ameisensäure hergestellt werden.
Ebenso ist die Synthese aus Rubidiumcarbonat und Ameisensäure unter Entwicklung von Kohlendioxid möglich.[4]
Aus Rubidiumhydrid und Kohlendioxid entsteht ebenfalls Rubidiumformiat.[5][6]
Eigenschaften
Rubidiumformiat existiert in zwei unterschiedlichen Kristallstrukturen. Bei 363 K findet der Phasenübergang statt.[7]
Gitterparameter der verschiedenen Modifikationen von Rubidiumformiat[7] Temperaturbereich Kristallsystem a [pm] b [pm] c [pm] β bis 363 K orthorhombisch 922,9 463,0 740,8 – über 363 K monoklin 465,52 465,28 751,70 97,610° Rubidiumformiat tritt bei Raumtemperatur als Hemihydrat auf. Unterhalb von 16,5 °C existiert es als Monohydrat, oberhalb von 51 °C als Anhydrat.[8] Die Löslichkeit von Rubidiumformiat in Wasser ist in untenstehender Tabelle beschrieben.
Löslichkeit von HCOORb in Wasser[8]
(angegeben in g HCOORb in 100 g gesättigter Lösung)Temperatur [°C] 3,3 7,8 9,5 14,0 16,3 28,3 43,6 49,9 60,8 101,7 Menge HCOORb [g] 78,86 80,71 81,37 83,59 84,61 83,60 87,77 89,23 90,06 93,89 Rubidiumformiat zersetzt sich beim Erhitzen, es entsteht zunächst unter Wasserstoffabspaltung Rubidiumoxalat, dieses zerfällt weiter in Rubidiumcarbonat und Kohlenmonoxid.[9]
Einzelnachweise
- ↑ a b c d Datenblatt Rubidiumformiat bei AlfaAesar, abgerufen am 26. Mai 2010 (JavaScript erforderlich).
- ↑ D. Leonesi, G. Berchiesi, A. Cingolani: "Electric Conductivity in Molten Binaries of Alkali Formates and Acetates", in: J. Chem. Eng. Data, 1975, 20(1), S. 31–32; doi:10.1021/je60064a026.
- ↑ a b Datenblatt Rubidium formate bei Sigma-Aldrich, abgerufen am 22. April 2011.
- ↑ N. V. Sidgwick, J. A. H. R. Gentle: "The solubilities of the alkali formates and acetates in water" in J. Chem. Soc., Trans. 1922, 121, S. 1837-1843 doi:10.1039/CT9222101837
- ↑ R. Abegg, F. Auerbach: Handbuch der anorganischen Chemie. Verlag S. Hirzel, Bd. 2, 1908. S. 425.Volltext
- ↑ "A Text-Book of Inorganic Chemistry", Verlag Forgotten Books, ISBN 978-1-4510-0469-4. S. 209. (Eingeschränkte Vorschau in der Google Buchsuche)
- ↑ a b Y. Masuda, W. Morita, A. Yahata, Y. Yukawa: "Structural studies on the phase transition of rubidium formate", in: Thermochimica Acta, 1998, 318, S. 39–43; doi:10.1016/S0040-6031(98)00327-X.
- ↑ a b Aterton Seidell: "Solubilities Of Organic Compounds Vol - I", S. 1429. Volltext
- ↑ T. Meisel, Z. Halmos, K. Seybold, E. Pungor: "The thermal decomposition of alkali metal formates" in Journal of Thermal Analysis and Calorimetry 1975, 7(1). S. 73-80. doi:10.1007/BF01911627
Wikimedia Foundation.





