- Rubidiumcarbonat
-
Strukturformel 
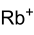
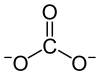
Allgemeines Name Rubidiumcarbonat Summenformel Rb2CO3 CAS-Nummer 584-09-8 PubChem 11431 Kurzbeschreibung weißer geruchloser Feststoff[1]
Eigenschaften Molare Masse 230,95 g·mol−1 Aggregatzustand fest
Dichte 3,55 g·cm−3[2]
Schmelzpunkt Löslichkeit Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [4] 
Achtung
H- und P-Sätze H: 315-319-335 EUH: keine EUH-Sätze P: 261-305+351+338 [4] EU-Gefahrstoffkennzeichnung [1] 
Reizend (Xi) R- und S-Sätze R: 36/37/38 S: 26-37/39 LD50 2630 mg·kg−1 (Ratte, peroral)[1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Rubidiumcarbonat ist eine chemische Verbindung aus der Gruppe der Rubidiumverbindungen und Carbonate.
Inhaltsverzeichnis
Gewinnung und Darstellung
Rubidiumcarbonat kann durch Reaktion von Ammoniumcarbonat mit Rubidiumhydroxid gewonnen werden.[5]
Eine andere Methode ist die Oxidation von Rubidiumoxalat.
Bei der Verarbeitung des Minerals Lepidolith erhält man ein Gemisch aus Kaliumcarbonat, Rubidiumcarbonat und Caesiumcarbonat.
Eigenschaften
Physikalische Eigenschaften
Rubidiumcarbonat ist ein weißer, geruchloser, feuchtigkeitsempfindlicher, luftempfindlicher, hygroskopischer Feststoff. Er kommt in drei Kristallmodifikationen vor, wobei bei Raumtemperatur nur die alpha-Form vorliegt. Die Raumgruppen für die Modifikationen sind P21/c (Gitterparameter a = 734,4 pm, b = 1011,6 pm, c = 587,26 pm, sowie vier Formeleinheiten pro Elementarzelle[2]), Pnma und P63/mmc. Sie entsprechen damit denen von Kalium- und Caesiumcarbonat.[6]
In 100 g absolutem Ethanol lösen sich 0,74 g Rubidiumcarbonat.[7]
Die Standardbildungsenthalpie von Rubidiumcarbonat beträgt -1150 kJ·mol−1.[8]
Chemische Eigenschaften
Rubidiumcarbonat dissoziiert oberhalb von 900 °C.[9]
Beim Einleiten von Kohlendioxid in die wäßrige Lösung bildet sich Rubidiumhydrogencarbonat.[10]
Beim Erhitzen mit Magnesium im Wasserstoffstrom bildet sich Rubidiumhydrid.[11]
Verwendung
Rubidiumcarbonat wird zur Herstellung von Spezialgläsern[12] und als Katalysator zur Herstellung von kurzkettigen Alkoholen aus Erdgas und zur Herstellung anderer Rubidiumverbindungen verwendet.[13]
Rubidiumcarbonat kann zur analytischen Trennung von Rubidium und Caesium verwendet werden, da es in Ethanol kaum löslich ist, Caesiumcarbonat jedoch gut löslich ist.[3]
Einzelnachweise
- ↑ a b c d e Eintrag zu CAS-Nr. 584-09-8 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 13. Juni 2010 (JavaScript erforderlich)
- ↑ a b Jean D'Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale, Band 3. 4. Auflage, Springer, 1997, ISBN 978-3-5406-0035-0, S. 684 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ a b K. A. Hofmann: "Lehrbuch der anorganischen Chemie", 2. Auflage 1919. Verlag F. Vieweg & Sohn, S. 439. Volltext
- ↑ a b Datenblatt Rubidium carbonate bei Sigma-Aldrich, abgerufen am 22. April 2011.
- ↑ 1911encyclopedia.com
- ↑ Konformationsaufklärung anorganischer Oxoanionen des Kohlenstoffs (Dissertation Uni Stuttgart)
- ↑ Aterton Seidell: "Solubilities Of Organic Compounds Vol - I", S. 1432; Volltext.
- ↑ Fania Moriseevna Perelman: "Rubidium and Caesium", Verlag Pergamon Press 1965. S. 46. (Eingeschränkte Vorschau in der Google Buchsuche), doi:10.1002/ange.19660780727.
- ↑ Dale L. Perry, Sidney L. Phillips: Handbook of inorganic compounds. CRC Press, 1995, ISBN 978-0-8493-8671-8, S. 333 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ R. Abegg, F. Auerbach: "Handbuch der anorganischen Chemie". Verlag S. Hirzel, Bd. 2, 1908. S. 435; Volltext.
- ↑ J. W. Mellor: "A comprehensive treatise on inorganic and theoretical chemistry", Band 2, Verlag Wiley 1962, S. 2186. (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ Rubidium and Rubidium Compounds
- ↑ Rubidium carbonate (micronmetals)
Wikimedia Foundation.





