- Tetramethylzinn
-
Strukturformel 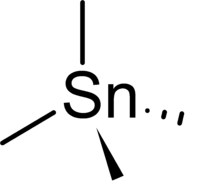
Allgemeines Name Tetramethylzinn Andere Namen - Zinntetramethyl
- Tetramethylstannan
Summenformel Sn(CH3)4 CAS-Nummer 594-27-4 PubChem 11661 Kurzbeschreibung niedrigviskose, brennbare, farblose Flüssigkeit
Eigenschaften Molare Masse 178,848 g·mol−1 Aggregatzustand flüssig
Dichte 1,29 g·cm−3[1]
Schmelzpunkt Siedepunkt 74–75 °C[1] (ohne Zersetzung)
Löslichkeit nahezu unlöslich in Wasser[1], löslich in unpolaren Lösemitteln
Brechungsindex 1,4410 (bei 20 °C, 589 nm)[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [1] 


Gefahr
H- und P-Sätze H: 225-300+310+330-410 EUH: keine EUH-Sätze P: 273-280-302+352-304+340-309+310-403+235 [1] EU-Gefahrstoffkennzeichnung [1] 


Leicht-
entzündlichSehr giftig Umwelt-
gefährlich(F) (T+) (N) R- und S-Sätze R: 11-26-27-28-50-53 S: 16-28-26-37-45-61 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C Tetramethylzinn, mit der chemischen Formel Sn(CH3)4, ist eine der einfachsten metallorganischen Zinnverbindungen. Die klare, farblose, dünnflüssige, leicht flüchtige Flüssigkeit hat einen unangenehmen, leicht muffigen Geruch. Tetramethylzinn kann zur Methylierung von organischen und anorganischen Halogeniden verwendet werden.
Inhaltsverzeichnis
Gewinnung und Darstellung
Tetramethylzinn kann durch Reaktion des Grignard-Reagenz Methylmagnesiumiodid mit Zinn(IV)-chlorid (SnCl4) hergestellt werden:[2]
Auch metallorganische Verbindungen anderer Elemente, wie Methylaluminiumverbindungen, können zur Methylierung von SnCl4 eingesetzt werden.[3]
Ebenso können SnCl4 und Methylchlorid direkt in Gegenwart von Natrium miteinander umgesetzt werden (Wurtz-Reaktion):[3]
Eigenschaften
Physikalische Eigenschaften
Tetramethylzinn ist leichtentzündlich, mit einem Flammpunkt von −12 °C und einer unteren Explosionsgrenze von 1,9 Vol-%.[1] Es hat eine Dichte von 1,29 g·cm−3 und einen Brechungsindex von 1,4410. Es ist nahezu unlöslich in Wasser aber gut mischbar mit unpolaren organischen Lösungsmitteln. Im Molekül ist das zentrale Zinnatom – äquivalent zum zentralen Kohlenstoffatom in Neopentan – von den vier Methylgruppen in einer tetraedrischen Anordnung umgeben. Die Stärke der Sn-C Bindung wird mit 71 kcal/mol angenommen.[4]
Chemische Eigenschaften
Tetramethylzinn ist aufgrund der guten Abschirmung des zentralen Metallatoms und der geringen Polarität der Sn–C-Bindung an der Luft stabil und weitgehend hydrolyseunempfindlich. Tetramethylzinn reagiert mit Säurechloriden unter Bildung von Methylketonen und mit Arylhalogeniden unter Bildung von Arylmethylketonen:
Auch auf anorganische Halogenide, wie SnCl4 oder BBr3, können vom Tetramethylzinn Methylgruppen übertragen werden:
 (Kocheshkov Umlagerung[5])
(Kocheshkov Umlagerung[5])
Verwendung
- im MOCVD-Verfahren (Metalorganic Chemical Vapour Deposition) bei der Herstellung von hochwertigen Zinn oder Zinnoxidfilmen für Solarzellen oder Gassensoren durch thermische Zersetzung bei 400–650 °C.[4][6][7]
- als Cokatalysator bei der Polymerisation von Cycloolefinen (Metathese). Im ersten Schritt bilden sich die entsprechenden aktiven Wolfram-Katalysatoren[8][9], Methyltrioxorhenium (MTO)[10] oder andere Rheniumkatalysatoren durch Methylierung des Zentralatoms:[11]
Sicherheitshinweise
Tetramethylzinn ist wie viele andere organische Zinnverbindungen als giftig eingestuft und muss daher mit entsprechender Vorsicht gehandhabt werden.
- Toxizität gegenüber Fischen, LC50: Dosis 6,44 mg/l (48 h) Oryzias latipes (Roter Killifisch).
- Toxizität gegenüber Daphnien und anderen wirbellosen Wassertieren, EC50: Dosis: 40 mg/l (24 h) Daphnia magna (Großer Wasserfloh). [1]
Zinnorganische Verbindungen schädigen das zentrale Nervensystem, was zu Krämpfen, Narkose und Atemlähmung führen kann. Es wird berichtet, dass Tetramethylzinn, welches – neben Triethyl- und Trimethylzinnverbindungen – bei der Produktion von Solarzellen eingesetzt wird, in Säugetieren rasch zu Trimethylzinn-Einheiten dealkyliert wird. Tierversuche zeigen, dass Trimethylzinn auf das zentrale Nervensystem wirkt und zu Vergiftungen führen kann, welche sich in reversiblen Nervenschäden bis zum Tod manifestieren können.[12]
Nachweis
Methode Eigenschaft/Signal NMR[2] 1H-NMR δ = 0,1 ppm; 13C-NMR δ = −9,5 ppm; 119Sn-NMR δ = 0 ppm (allgemeinüblicher Standard) MS[13] Tetramethylzinn zerfällt im Massenspektrum als erstes unter Bildung des Fragmentes +Sn(CH3)3, welches eine Gruppe von Signalen, entsprechend der Isotopenverteilung des Zinns, zeigt. Das Molekülion +Sn(CH3)4 wird nicht detektiert. Weitere Fragmente sind +Sn(CH3)2, +SnCH3 und Sn+ Einzelnachweise
- ↑ a b c d e f g h i j Datenblatt Tetramethylzinn bei Merck, abgerufen am 13. November 2011.
- ↑ a b Scott, W. J.; Jones, J. H.; Moretto, A. F.: Tetramethylstannane. In: Encyclopedia of Reagents for Organic Synthesis. 2002. doi:10.1002/047084289X.rt070.
- ↑ a b Alwyn George Davies: Organotin chemistry, Band 1. Wiley-VCH Verlag GmbH & Co. KGaA, 2004, ISBN 3-527-31023-1 (Seite 46–48 in der Google Buchsuche).
- ↑ a b Roland A. Fischer: Precursor chemistry of advanced materials. Springer-Verlag Berlin, 2005, ISBN 1436-6002 (Seite 7 in der Google Buchsuche).
- ↑ Alwyn George Davies: Organotin chemistry, Band 1. Wiley-VCH Verlag GmbH & Co. KGaA, 2004, ISBN 3-527-31023-1 (Seite 167 in der Google Buchsuche).
- ↑ Yuichiro Okajima et al.: Proceedings of the Third International Symposium on Ceramic Sensors. The Electrochemical Society Inc., 1997, ISBN 1-56677-127-7 (Seite 69 in der Google Buchsuche).
- ↑ Cynthia J. Bruckner-Lea: Chemical sensors 6. The Electrochemical Society Inc., 2004, ISBN 1-56677-421-7 (Seite 42 in der Google Buchsuche).
- ↑ Manfred Dieter Lechner, Klaus Gehrke, Eckhard H. Nordmeier: Makromolekulare Chemie: ein Lehrbuch für Chemiker, Physiker. Birkhäuser Verlag, 2010, ISBN 978-3-7643-8890-4 (Seite 100 in der Google Buchsuche).
- ↑ Christoph Janiak, Thomas M. Klapötke, Hans-Jürgen Meyer, Erwin Riedel: Moderne anorganische Chemie. de Gruyter, 2003, ISBN 3-11-017838-9 (Seite 741 in der Google Buchsuche).
- ↑ Patent WO2010075972A2: METHOD FOR PRODUCING METHYL TRIOXORHENIUM (MTO).
- ↑ Patent DE3940196A1: Organo-rhenium oxide cpds. - useful on oxide support materials, as catalysts for metathesis of olefin(s), esp. functional olefin(s).
- ↑ L. D. Hamilton, W. H. Medeiros, P. D. Moskowitz, K. Rybicka: "Toxicology of tetramethyltin and other organometals used in photovoltaic cell manufacture" AIP Conf. Proc., 1988, Volume 166, Issue 1, S. 54–66; doi:10.1063/1.37131.
- ↑ Chaterine E. Housecroft, Edwin C. Constable: Chemistry. Pearson Education Limited, 2010, ISBN 978-0-273-71545-0 (Seite 367 in der Google Buchsuche).
Literatur
- Alwyn George Davies, Keith Pannell: Tin chemistry: fundamentals, frontiers, and applications. John Wiley & Sons Ltd, 2008, ISBN 978-0-470-51771-0 (Seite 1 in der Google Buchsuche).
Kategorien:- Giftiger Stoff
- Feuergefährlicher Stoff
- Umweltgefährlicher Stoff
- Zinnverbindung
- Metallorganische Verbindung
Wikimedia Foundation.






![\mathrm{ Sn(CH_3)_4\ +\ 8\ O_2 \quad \xrightarrow[- 6\ H_2O\ - 4\ CO_2]{470^\circ C} \ SnO_2 }](1/5c1caf47cff244a829882ebc93a05c88.png)
![\mathrm{ WCl_6\ +\ 2\ Sn(CH_3)_4 \quad \xrightarrow[- 2\ ClSn(CH_3)_3]{} \quad Cl_4W=(CH_3)_2\ \quad \xrightarrow[- CH_4]{} \quad Cl_4W=CH_2}](8/798f244af6d10671683ab44152d0af50.png)
