- Trimethylsilanol
-
Strukturformel 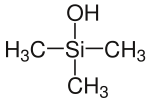
Allgemeines Name Trimethylsilanol Andere Namen - Hydroxytrimethylsilan
- Trimethylhydroxysilan
Summenformel C3H10OSi CAS-Nummer 1066-40-6 PubChem 66110 Kurzbeschreibung farblose klare Flüssigkeit[1]
Eigenschaften Molare Masse 90,20 g·mol−1 Aggregatzustand flüssig
Dichte 0,95 g·cm−3[1]
Schmelzpunkt Siedepunkt Dampfdruck 21 mbar (20 °C)[4]
Löslichkeit 35–43 g·l−1 in Wasser [5]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [6] 
Gefahr
H- und P-Sätze H: 225 EUH: keine EUH-Sätze P: 210 [6] EU-Gefahrstoffkennzeichnung [7] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Trimethylsilanol (TMS), ist eine chemische Verbindung und gehört zu den Silanolen. Es ist ein Derivat von Silan und das Siliciumanalogon von tert-Butanol.
Inhaltsverzeichnis
Darstellung und Gewinnung
Eine einfache Hydrolyse des Chlortrimethylsilans führt wegen des Nebenprodukts Salzsäure eher zum Veretherungsprodukt Hexamethyldisiloxan. Durch eine schwach basisch geführte Hydrolyse ist Trimethylsilanol zugänglich, da so die Dimerisierung vermieden werden kann.[8] Trimethylsilanol kann auch durch die basische Hydrolyse von Hexamethyldisiloxan gewonnen werden.[9]
Eigenschaften
Trimethylsilanol ist eine flüchtige organische Flüssigkeit mit einem Siedepunkt von 98 °C.[3] Die Verdampfungswärme beträgt 45,64 kJ·mol−1, die Verdampfungsentropie 123 J·K−1·mol−1[4] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 5,44591, B = 1767,766 und C = −44,888 im Temperaturbereich von 291 K bis 358 K.[4] Unterhalb des Schmelzpunktes bei −4,5 °C[2] erstarrt die Verbindung in einem monoklinen Kristallgitter.[10] Trimethylsilanol ist mit einem pKa-Wert von 11 eine schwache Säure.[11] Die Säurestärke ist vergleichbar mit der der Orthokieselsäure, aber wesentlich höher als bei Alkoholen wie z.B. tert.-Butanol (pKa 19[11]).
Verwendung
TMS wird für die hydrophobe Beschichtung bei Silicat-Oberflächen eingesetzt. Es reagiert mit den Siliciumatomen des Substrats, wodurch eine Schicht aus Methylgruppen entsteht. TMS tritt üblicherweise als Verunreinigung in Raumschiffen auf, da es aus den Silikon-basierten Materialien ausgast.[12]
Wie andere Silanole wird TMS für den Einsatz als antimikrobieller Wirkstoff untersucht.[13]
TMS ist ein mögliches Hydrolyseprodukt von PDMS-Ketten-Endgruppen.
Siehe auch
Einzelnachweise
- ↑ a b Trimethylsilanole. Abgerufen am 7. November 2009
- ↑ a b Batuew et. al. in Doklady Akademii Nauk SSSR 95 (1954) 531.
- ↑ a b Stepovik, L. P.; Kazakina, S. V.; Martynova, I. M. in Russian Journal of General Chemistry – English Version 70 (2000) 1371–1377 oder Zhurnal Obshchei Khimii 70 (2000) 1459–1461.
- ↑ a b c Grubb, W.T.; Osthoff, R.C.: Physical Properties of Organosilicon Compounds. II. Trimethylsilanol and Triethylsilanol in J. Am. Chem. Soc. 75 (1953) 2230–2232.doi:10.1021/ja01105a061
- ↑ S. M. Mazzoni, S. Roy, S. Grigoras: Eco-Relevant Properties of Selected Organosilicon Materials. In: G. Chandra (Hrsg.): The Handbook of Environmental Chemistry – Organosilicon Materials. Springer-Verlag, Berlin/Heidelberg 1997, ISBN 3-540-62604-2 (Vol. 3, Part H)
- ↑ a b Datenblatt Trimethylsilanol bei Sigma-Aldrich, abgerufen am 24. April 2011.
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ J.A. Cella, J.C. Carpenter: Procedures for the preparation of silanols in J. Organomet. Chem. 480 (1994) 23–23 doi:10.1016/0022-328X(94)87098-5
- ↑ M. Lovric, I. Cepanec, M. Litvic, A. Bartolincic, V. Vinkovic: Croatia Chem. Acta 80 (2007) 109–115
- ↑ R. Minkwitz, S. Schneider: Z. Naturforsch. B, Chem. Sci. 53 (1998) 426–429.
- ↑ a b T. Kagiya, Y. Sumida, T. Tachi: An Infrared Spectroscopic Study of hydrogen Bonding Interaction. Structural Studies of Proton-donating and -accepting Powers in Bull. Chem. Soc. Japan 43 (1970) 3716–3722.
- ↑ Trimethylsilanol, Harold L. Kaplan, Martin E. Coleman, and John T. James Spacecraft Maximum Allowable Concentrations for Selected Airborne Contaminants, Volume 1 (1994)
- ↑ Yun-mi Kim, Samuel Farrah, Ronald H. Baney: Silanol – A novel class of antimicrobial agent. In: Electronic Journal of Biotechnology. 9, Nr. 2, 2006, S. 176. doi:10.2225/vol9-issue2-fulltext-4.
Weblinks
- Eintrag zu Trimethylsilanol in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich)
Kategorie:- Organosilanol
Wikimedia Foundation.
