- Tert-Butanol
-
Strukturformel 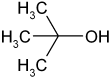
Allgemeines Name 2-Methyl-2-propanol Andere Namen - 2-Methylpropan-2-ol
- tert-Butylalkohol
- tert-Butanol
- Trimethylcarbinol
Summenformel C4H10O CAS-Nummer 75-65-0 PubChem 6386 Kurzbeschreibung farblose Flüssigkeit mit campherartigem Geruch [1] Eigenschaften Molare Masse 74,12 g·mol−1 Aggregatzustand flüssig
Dichte 0,79 g·cm−3 [1]
Schmelzpunkt Siedepunkt 83 °C [1]
Dampfdruck Löslichkeit Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 

Leicht-
entzündlichGesundheits-
schädlich(F) (Xn) R- und S-Sätze R: 11-20-36/37 S: (2)-9-16-46 MAK 20 ml·m−3 bzw. 62 mg·m−3
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. 2-Methyl-2-propanol (auch tert-Butylalkohol oder tert-Butanol) ist der einfachste tertiäre Alkohol.
Inhaltsverzeichnis
Gewinnung und Darstellung
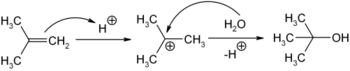
Man gewinnt 2-Methyl-2-propanol durch elektrophile Addition von Wasser an Isobuten in Gegenwart von Schwefelsäure als Katalysator:
Bei dieser Reaktion bildet sich fast ausschließlich das 2-Methyl-2-propanol und nicht das isomere 2-Methyl-1-propanol (Isobutanol), da bei der anfänglichen Protonierung des Isobutens durch die Schwefelsäure nur das stabilere tert-Butyl-Kation gebildet wird (Markownikow-Regel).
Eigenschaften
Physikalische Eigenschaften
2-Methyl-2-propanol ist ein bei Raumtemperatur schmelzender, aber meist noch größtenteils fester, farbloser Stoff, der charakteristisch campherartig riecht. Der Stoff ist ein tertiärer Alkohol, das bedeutet, dass das Kohlenstoff-Atom, an das die Hydroxyl-Gruppe gebunden ist, selbst an drei weitere Kohlenstoff-Atome gebunden ist. Wie alle Butanole ist auch 2-Methyl-2-propanol brennbar.
Thermodynamische Eigenschaften
Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 4,49774, B = 1174,869 und C = −93,92 im Temperaturbereich von 312,66 bis 355,56 K.[3]
Zusammenstellung der wichtigsten thermodynamischen Eigenschaften Eigenschaft Typ Wert [Einheit] Bemerkungen Standardbildungsenthalpie ΔfH0liquid
ΔfH0gas−359,2 kJ·mol−1[4]
−312,6 kJ·mol−1 [4]Standardentropie S0liquid
S0solid189,5 J·mol−1·K−1[5]
170,87 J·mol−1·K−1[6]als Flüssigkeit
als FeststoffVerbrennungsenthalpie ΔcH0liquid −2644,0 kJ·mol−1[7] Wärmekapazität cp 215,37 J·mol−1·K−1 (25 °C)[8]
113,63 J·mol−1·K−1 (25 °C)[9]als Flüssigkeit
als GasKritische Temperatur Tc 506,2 K [10] Kritischer Druck pc 39,7 bar [10] Verdampfungsenthalpie ΔVH0 39,07 kJ·mol−1 [11] beim Normaldrucksiedepunkt Sicherheitstechnische Kenngrößen
2-Methyl-2-propanol gilt als entzündliche Flüssigkeit. Oberhalb der Flammpunktes können sich entzündliche Dampf-Luft-Gemische bilden. Die Verbindung hat einen Flammpunkt bei 11 °C.[12] Der Explosionsbereich liegt zwischen 1,7 Vol% (52 g/m3) als untere Explosionsgrenze (UEG) und 8 Vol% (250 g/m3) als obere Explosionsgrenze (OEG).[12] Die Zündtemperatur beträgt 470 °C.[12] Der Stoff fällt somit in die Temperaturklasse T1.
Chemische Eigenschaften
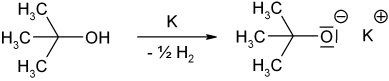
Wie alle aliphatischen Alkohole kann die Hydroxylgruppe des 2-Methyl-2-propanols deprotoniert werden und man erhält das tert-Butylat-Anion. Ein bekanntes und in der organischen Synthesechemie oft verwendetes Salz ist das Kalium-tert-butanolat, das z. B. durch Reaktion von 2-Methyl-2-propanol mit elementarem Kalium zugänglich ist.
Dieses stark basische Salz findet als sterisch anspruchsvolle, aber nur schwach nucleophile Base Anwendung, zum Beispiel bei Deprotonierungen, bei denen die Base nicht nucleophil angreifen darf. Oft verwendet man dann auch 2-Methyl-2-propanol als Lösungsmittel.
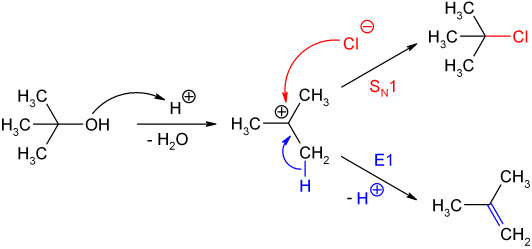
Von starken Protonensäuren (Salzsäure, Schwefelsäure, Phosphorsäure etc.) wird 2-Methyl-2-propanol am Sauerstoffatom protoniert und unter Abspaltung von Wasser bildet sich das tert-Butyl-Kation, das durch den Hyperkonjugationseffekt der drei Methylgruppen stabilisiert ist. In Gegenwart von guten Nukleophilen verläuft die Reaktion im Sinne einer nucleophilen Substitution (SN1) weiter. Beispielsweise bildet sich das 2-Chlor-2-methylpropan (tert-Butylchlorid) sehr leicht aus 2-Methyl-2-propanol und konz. Salzsäure. Sind keine geeigneten Nukleophile zugegen (z. B. bei Verwendung von Schwefelsäure oder Phosphorsäure), so verläuft die Reaktion im Sinne einer Eliminierung (E1) zu 2-Methylpropen (Isobuten). Dies ist die Umkehrung der Herstellung von 2-Methyl-2-propanol.
Verwendung
Es ist ein Treibstoffzusatz und dient als Antiklopfmittel und ist Ausgangsstoff zur Synthese von tert-Butylestern und tert-Butylphenolen, die wiederum als Antioxidantien verwendet werden. Man benutzt es außerdem bei der gaschromatographischen Blutalkoholbestimmung (Headspace-GC) als internen Standard. Weiterhin wird es als zusätzliches Vergällungsmittel für Trinkalkohol (Ethanol) verwendet.
In der Synthesechemie wird es u. a. auch zur Entsorgung von Kalium-Resten verwendet, da es mit Kalium kontrollierbar zu Kalium-tert-butanolat reagiert.
Sicherheitshinweise
2-Methyl-2-propanol kann beim Haut- und Augenkontakt reizend wirken. Beim Einatmen verursacht es weiterhin Husten, dadurch wird es auch vom Körper resorbiert. Bei Verschlucken kann es zu Übelkeit und Erbrechen kommen. Nach der Resorption können Benommenheit, Schwindel, Atemlähmung, Blutdruckabfall und Herz-Kreislaufstörungen auftreten. Deshalb trägt der Stoff das Gefahrensymbol Xn – es ist gesundheitsschädlich. Weiterhin ist es als leichtentzündlich (Symbol F) eingestuft. 2-Methyl-2-propanol ist schwach wassergefährdend (Wassergefährdungsklasse 1).
Quellen
- ↑ a b c d e f Eintrag zu 2-Methyl-2-propanol in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 11. Sep. 2007 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 75-65-0 im European chemical Substances Information System ESIS
- ↑ Brown, I.; Fock, W.; Smith, F.: The Thermodynamic Properties of Solutions of Normal and Branched Alcohols in Benzene and n-Hexane in J. Chem. Thermodyn. 1 (1969) 273-291.
- ↑ a b Wiberg, K.B.; Hao, S., Enthalpies of hydration of alkenes. 4. Formation of acyclic tert-alcohols in J. Org. Chem. 56 (1991) 5108-5110.
- ↑ Parks, G.S.: Kelley, K.K.; Huffman, H.M., Thermal data on organic compounds. V. A revision of the entropies and free energies of nineteen organic compounds in J. Am. Chem. Soc. 51 (1929) 1969-1973.
- ↑ Oetting F.L.: The heat capacity and entropy of 2-methyl-2-propanol from 15 to 330 K in J. Phys. Chem. 67 (1963) 2757-2761.
- ↑ Skinner, H.A.; Snelson, A.: The heats of combustion of the four isomeric butyl alcohols in Trans. Faraday Soc. 56 (1960) 1776-1783.
- ↑ Caceres-Alonso, M.; Costas, M.: Andreoli-Ball, L.; Patterson, D., Steric effects on the self-association of branched and cyclic alcohols in inert solvents. Apparent heat capacities of secondary and tertiary alcohols in hydrocarbons in Can. J. Chem. 66 (1988) 989-998.
- ↑ Thermodynamics Research Center, Selected Values of Properties of Chemical Compounds., Thermodynamics Research Center, Texas A&M University, College Station, Texas, 1997.
- ↑ a b Gude, M.; Teja, A.S.: Vapor-Liquid Critical Properties of Elements and Compounds. 4. Aliphatic Alkanols in J. Chem. Eng. Data 40 (1995) 1025-1036.
- ↑ Majer, V.; Svoboda, V., Enthalpies of Vaporization of Organic Compounds: A Critical Review and Data Compilation, Blackwell Scientific Publications, Oxford, 1985, 300
- ↑ a b c E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen - Band 1: Brennbare Flüssigkeiten und Gase, Wirtschaftsverlag NW – Verlag für neue Wissenschaft GmbH, Bremerhaven 2003
Weblinks
Wikimedia Foundation.