- Coenzym Q
-
Ubichinon (auch UQ, Coenzym Q, CoQ, Q oder Coenzym Q10) ist ein Chinon-Derivat mit lipophiler Isoprenoid-Seitenkette, strukturell verwandt mit Vitamin K und Vitamin E. Die reduzierte, phenolische Form wird Ubihydrochinon oder Ubichinol (kurz QH2) genannt. Den Namen „Ubichinon“ verdankt das Coenzym der Tatsache, dass es in lebenden Organismen ubiquitär verbreitet, also allgegenwärtig, ist.
Coenzym Q ist ein essentieller Elektronen- und Protonen-Überträger zwischen dem Komplex I bzw. Komplex II und dem Komplex III der Atmungskette.
Q10 wird als Bestandteil von kosmetischen Cremes sowie auch als Nahrungsergänzungsmittel zum Verkauf angeboten.
Inhaltsverzeichnis
Chemie
Molekülstruktur
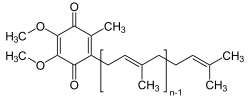
Grundkörper des Ubichinons ist das zur Stoffgruppe der Chinone zählende 1,4-Benzochinon, das in den Positionen 2 und 3 eine Methoxygruppe, in der Position 6 eine Methylgruppe und in der Position 5 eine Isoprenoid-Seitenkette enthält. Die Ubichinone werden entweder nach Anzahl der Isopren-Einheiten (n) in der Seitenkette als Q-1, Q-2, Q-3 usw. oder nach Anzahl der C-Atome in der Seitenkette als UQ-5, UQ-10, UQ-15 usw. bezeichnet. In der Hefe Saccharomyces cerevisiae findet sich Q-6, im Bakterium Escherichia coli Q-8, in Nagetieren Q-9 und in den meisten anderen Säugetieren einschließlich des Menschen überwiegt Q-10.
Die hydrophobe Isoprenoid-Seitenkette ermöglicht die Verankerung des Moleküls im ebenfalls hydrophoben Bereich der Biomembranen, die die Mitochondrien aufbauen.
Eigenschaften
Coenzym Q10 ist ein gelb-oranges, kristallines Pulver ohne Geruch und Geschmack.
Biologische Funktion
Coenzym Q10 ist eine körpereigene Substanz, die für den Menschen essentiell ist. Es wird zum Teil über die Nahrung aufgenommen, aber auch im Körper selbst produziert. In jeder menschlichen Zelle wird die Energie aus der Nahrung in körpereigene Energie (ATP) umgewandelt. Coenzym Q10 ist als Coenzym an der oxidativen Phosphorylierung beteiligt, über die 95 % der gesamten Körperenergie (ATP) erzeugt wird.[1][2] Die Organe mit dem höchsten Energiebedarf – wie Herz, Lunge und Leber – weisen deshalb auch die höchste CoQ10-Konzentration auf.[3]
Biochemie
Die Atmungskette in den Mitochondrien der Zelle ermöglicht den stufenweisen Transfer von Elektronen und Protonen auf Sauerstoff bei gleichzeitiger Gewinnung von ATP als biochemisches Energieäquivalent. Diese Reaktionsfolge, die gelegentlich als „kontrollierte Knallgasreaktion“ bezeichnet wird, findet an lokalisierten Membranproteinen, den Komplexen I bis V, und mobilen Komponenten, Ubichinon und Cytochrom c, statt. Letztere dienen als Shuttlesysteme zwischen den Komplexen: Ubichinon vermittelt, wie bereits erwähnt, zwischen den Komplexen I/II und III, Cytochrom c zwischen den Komplexen III und IV.
Die Elektronen zur Reduktion des Ubichinons entstammen der Oxidation des NADH am Komplex I der Atmungskette, der NADH-Dehydrogenase, bzw. von der Oxidation von Succinat am Komplex II, welcher mit der Succinat-Dehydrogenase des Citratzyklus identisch ist. Ein Ubichinon-Molekül kann dabei schrittweise zwei Elektronen aufnehmen. Im ersten Schritt bildet sich ein recht stabiles Semichinon-Radikal. Die Aufnahme des zweiten Elektrons lässt nach der Protonierung das Hydrochinon Ubichinol, die reduzierte Form also, entstehen. Dies ermöglicht neben dem Elektronentransport auch die Bindung zweier Protonen – Ubichinon kann somit auch als Protonencarrier dienen. Diese Vorgänge sind innerhalb der Atmungskette im Q-Zyklus am Komplex III von Bedeutung.
Prooxidante und antioxidante Eigenschaften
Ubichinon ist auch involviert bei der Bildung von reaktiven Sauerstoffspezies (ROS) durch die Entstehung von Superoxid durch Ubisemichinon-Radikale, die oxidative Beschädigungen verursachen, die vielen degenerativen Krankheiten zugrunde liegt. Paradoxerweise ist der Ubichinon-Pool auch ein wichtiges mitochondriales Antioxidans.[4]
Mangel
Ein CoQ-Mangel entsteht durch altersbedingte Abnahme der CoQ-Konzentration, körperlicher Anstrengung, Stress, erhöhtem Alkohol- und Nikotinkonsum sowie Krankheiten. Manche cholesterinsenkende Medikamente (die sogenannten „Statine“) hemmen die körpereigene Produktion von CoQ.
Nahrungsergänzung
Über die Nahrung nehmen wir täglich etwa drei bis fünf Milligramm des Coenzyms auf.[5] Bei erhöhtem CoQ10-Bedarf kann eine Nahrungsergänzung helfen, einen Mangel zu vermeiden oder auszugleichen. Für einen Erwachsenen beträgt die von den meisten Wissenschaftlern empfohlene Dosierung von CoQ10 als Nahrungsergänzung 30-200 mg pro Tag.[6][7][8]
Kosmetik
Q10 ist auch propagierter Wirkstoff von vielfach angebotenen Hautcremes. Sie sollen den im Alter zunehmenden Mangel an Q10 ausgleichen und z.B. den Abbau von schädlichen Radikalen sicherstellen. [9]
Vorkommen
Bei ausgewogener Ernährung ist die Zufuhr des Coenzyms im Normalfall sichergestellt. CoQ10 findet sich reichhaltig im Fleisch von Organen (Leber), öligem Fisch (Sardinen, Makrelen usw.), Nüssen (z.B. Pistazien), Hülsenfrüchten, Sesamsamen, Sonnenblumenkernen, Pflanzenölen, Kohl, Zwiebeln, Kartoffeln, Spinat, Rosenkohl und Brokkoli. Kochen kann das Coenzym jedoch zerstören.
Herstellung
Für die Herstellung von CoQ10 werden drei Verfahren eingesetzt: Fermentation von Hefen, Fermentation von Bakterien und chemische Synthese.
Beim Hefefermentationsverfahren entsteht CoQ10 in der so genannten trans-Konfiguration, was bedeutet, dass es identisch ist mit dem natürlich auftretenden CoQ10, wie man es in Fleisch, Fisch oder anderen Lebensmitteln findet.
Die Sicherheit von Hefefermentation wurde durch mehrere Sicherheitsstudien bestätigt, die von einem der weltweit führenden Versuchslaboratorien (Covance Laboratories Inc.)[10] durchgeführt wurden. Darüber hinaus wurde in einer doppelblinden, randomisierten, placebokontrollierten Studie nachgewiesen, dass CoQ10 von Hefefermentation in Dosierungen bis 900 Milligramm pro Tag absolut sicher und gut verträglich ist. [11]
Das durch chemische Synthese hergestellte CoQ10 enthält jedoch auch das cis-Isomer (eine im natürlich auftretenden CoQ10 nicht vorhandene Molekularstruktur), das jedoch in der kommerziellen Produktion durch Reinigungsschritte entfernt wird. Durch chemische Synthese hergestelltes CoQ10 verfügt üblicherweise über einen höheren Reinheitsgrad.
Geschichte
Coenzym Q10 wurde 1957 entdeckt und erstmals von Fred L. Crane aus Rinder-Herzen isoliert.[12] Die chemische Struktur konnte 1958 von Karl Folkers aufgeklärt werden.[13] Für die Erkenntnisse über die Rolle von Coenzym Q im Q-Zyklus des Komplex III der Atmungskette erhielt der britische Wissenschaftler Peter Dennis Mitchell 1978 den Nobelpreis für Chemie.
Quellen
- ↑ Ernster, L. & Dallner, G. (1995): Biochemical, physiological and medical aspects of ubiquinone function. Biochim. Biophys. Acta. Bd. 1271, S. 195-204. PMID 7599208
- ↑ Dutton, P.L. et al.: Coenzyme Q oxidation reduction reactions in mitochondrial electron transport. In: Kagan, V.E. & Quinn, P.J. (Hrsg.): Coenzyme Q: Molecular mechanisms in health and disease. CRC Press, 2000, S. 65-82.
- ↑ Shindo, Y., Witt, E., Han, D., Epstein, W., and Packer, L., Enzymic and non-enzymic antioxidants in epidermis and dermis of human skin, Invest. Dermatol., 102 (1994) 122-124.
- ↑ James, A.M. et al. (2004): Antioxidant and prooxidant properties of mitochondrial Coenzyme Q. In: Arch. Biochem. Biophys. Bd. 423, S. 47-56. PMID 14989264
- ↑ Weber, C.: Dietary intake and absorption of coenzyme Q. In: Kagan, V.E. & Quinn, P.J. (Hrsg.): Coenzyme Q: Molecular mechanisms in health and disease. CRC Press, 2000, S. 209-215.
- ↑ Kalén A, Appelkvist E-L, Dallner G: Age-related changes in the lipid compositions of rat and human tissues. Lipids 24: 579-584, 1989
- ↑ Crane FL: Biochemical functions of coenzyme Q10. J Am Coll Nutr 20: 591-598, 2001
- ↑ Hendler SS, Rorvic MS (Eds): Coenzyme Q10 (CoQ10) In: Physician desk reference (PDR) for nutritional supplements (First Edition). Medical Economics Company, New Jersey, pp 103-106, 2001
- ↑ http://www.chemie-im-alltag.de/articles/0126/
- ↑ Williams KD, Maneka JD, AbdelHameed M, Hall RL, PalmerTE, Kitano M, Hidaka T: 52-Week oral gavage chronic toxicity study with ubiquinone in rats with a 4-week recovery. J Agric Food Chem 47 : 3756-3763, 1999
- ↑ Ikematsu H, Nakamura K, Harashima S, Fujii K and Fukutomi N: Safety assessment of Coenzyme Q10 (Kaneka Q10) in healthy subjects: A double-blind, randomized, placebo-controlled trial. Regul Toxicol & Pharmacol 44:212-218, 2006
- ↑ Crane, F.L. et al. (1957): Isolation of a quinone from beef heart mitochondria. In: Biochim. Biophys. Acta. Bd. 25, S. 220-221. PMID 13445756
- ↑ Nachruf: Karl Folkers
Literatur
- Crane, F.L. (2001): Biochemical functions of coenzyme Q10. In: J. Am. Coll. Nutr. Bd. 20, S. 591-598. PMID 11771674 freier Volltextzugriff PDF-Format
- Ely, J.T.A. & Krone, C.A. (2000): A brief update on ubiquinone (coenzyme Q10). In: J. Orthomolecular. Med. Bd. 15, S. 63–68. HTML
- Ernster, L. & Dallner, G. (1995): Biochemical, physiological and medical aspects of ubiquinone function. Biochim. Biophys. Acta. Bd. 1271, S. 195-204. PMID 7599208
- Thomas Spengler: Gesundheit durch Vitalstoffe. Selbstverlag, 2004, ISBN 3-00-012604-X
- Fahl, Arnulf: Vitalstoffe, die Medizin der Zukunft. Vitavital GmbH & Co KG, 2004.
Siehe auch
Weblinks
- Bundesinstitut für Risikobewertung: Ernährungsmedizinische Beurteilung von Werbeaussagen zu Coenzym Q 10. Stellungnahme vom 20. April 2001. (PDF)
- Naturheilkundlicher Newsletter der Habichtswald-Klinik Kassel: Ubichinon Q10 – Wundermittel oder unnötige Nahrungsergänzung? (PDF-Format)
- Vorteile durch Q10 und Vitamin E in wasserlöslicher Form: Q10 wasserlöslich
- www.phytodoc.de: Coenzym Q 10
- arznei-telegramm: Coenzym Q10 stört orale Antikoagulation
- Possible Health Benefits of Coenzyme Q10 (englisch)
- Introduction to Coenzymne Q10 (englisch)
- IUPAC Nomenklatur der Chinone (englisch)
Wikimedia Foundation.