- Isopren
-
Strukturformel 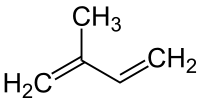
Allgemeines Name Isopren Andere Namen 2-Methylbuta-1,3-dien
Summenformel C5H8 CAS-Nummer 78-79-5 PubChem 6557 Kurzbeschreibung farblose, hochentzündliche Flüssigkeit mit charakteristischem Geruch[1]
Eigenschaften Molare Masse 68,12 g·mol−1 Aggregatzustand flüssig
Dichte 0,68 g·cm−3[1]
Schmelzpunkt Siedepunkt 34 °C[1]
Dampfdruck Löslichkeit - sehr schlecht in Wasser (0,7 g·l−1 bei 20 °C)[1]
- gut in Ethanol und Diethylether[2]
Brechungsindex 1,4218 [2]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [3] 

Gefahr
H- und P-Sätze H: 224-350-341-412 EUH: keine EUH-Sätze P: 210-201-281-273-308+313-403+235 [1] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3](nicht stabilisiert) 

Hoch-
entzündlichGiftig (F+) (T) R- und S-Sätze R: 45-68-12-52/53 S: 53-45-61 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C Isopren ist der Trivialname für den ungesättigten Kohlenwasserstoff 2-Methylbuta-1,3-dien. Es ist ein Derivat des 1,3-Butadiens. Isopren ist die Grundeinheit der Terpene, wird selbst aber meist nicht zu diesen gezählt.
Inhaltsverzeichnis
Synthese
Ethen reagiert mit Propen zu 2-Methylbuten. 2-Methylbuten wird an Chromoxid-Aluminiumoxid-Katalysatoren zum Isopren dehydriert.
Biologische Bedeutung und Vorkommen
Vom Isopren lassen sich formal viele Naturstoffe ableiten, die zu den isoprenoiden Naturstoffen zusammengefasst werden. Ein Beispiel hierfür sind die Steroide und Terpene. Der direkte Vorläufer und Ausgangspunkt der Biosynthese der Isoprenoide ist jedoch nicht Isopren, sondern das biochemisch aktivierte Isopentenyl-Pyrophosphat (IPP) und dessen Isomer Dimethylallyl-Pyrophosphat (DMAPP). Isopren selbst wird von vielen Bäumen und Phytoplankton produziert; der Grund dafür ist aber nicht geklärt. Gemäß einer Hypothese soll das gasförmige Isopren die Pflanzen vor Oxidation durch bodennahes Ozon schützen.
Isopren kommt verknüpft in wiederholenden Einheiten in Membranen der Archaea vor. Dort bilden sie die hydrophoben Anteile der Lipide und sind über Etherbindungen mit Glycerinmolekülen verknüpft. Die Isopreneinheiten der äußeren und inneren Schicht können sich verbinden, sodass eine einlagige Lipidschicht entsteht.
Verwendung
Zur Herstellung von Isopren-Kautschuk (IR), daneben auch für Naturstoffsynthesen, z. B. für α-Terpineol.
Sicherheitshinweise und Toxikologie
Isopren ist nur von geringer akuter Toxizität: Der orale LD50-Wert für Ratten ist >2000 mg/kg. Isopren kann inhalativ und durch Verschlucken aufgenommen werden. Der Kontakt mit Augen und Haut erzeugt Rötungen und Schmerz, eine Inhalation ruft Husten, Übelkeit, Brennen und flachen Atem hervor. Im Tierversuch wirkt Isopren krebserregend und erbgutverändernd.
Reaktionen
Isopren dimerisiert im Sinne einer Diels-Alder-Reaktion beim Erhitzen zu Limonen; die Reaktion gelang erstmals Gustave Bouchardat im Jahr 1878.
Isopren wird mit Acrylsäuremethylester in einer Diels-Alder-Reaktion zu racemischen 4-Methylcyclohex-3-en-1-carbonsäuremethylester umgesetzt. Dieser ergibt in einer Grignard-Reaktion mit Methylmagnesiumbromid (CH3MgBr, Grignard-Reagenz) nach Hydrolyse α-Terpineol:

Einzelnachweise
- ↑ a b c d e f g Eintrag zu CAS-Nr. 78-79-5 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 13.01.2008 (JavaScript erforderlich).
- ↑ a b Thieme Chemistry (Hrsg.): RÖMPP Online - Version 3.5. Georg Thieme Verlag KG, Stuttgart 2009.
- ↑ a b Eintrag zu CAS-Nr. 78-79-5 im European chemical Substances Information System ESIS (ergänzender Eintrag)
Wikimedia Foundation.
