- Cumarin (Farbstoff)
-
Cumarin-Farbstoffe (engl. Coumarin dyes) sind eine Klasse von fluoreszierenden Farbstoffen die ursprünglich zur Verwendung in Farbstofflasern entwickelt wurden, aber auch als polaritäts-, pH- und viskositätssensitive Fluorophore, sowie als Fluoreszenzlabel bzw. -marker Verwendung finden. Bei ihnen handelt es sich um Derivate von Cumarin, einem natürlich vorkommenden sekundären Pflanzenstoff.
Inhaltsverzeichnis
Aufbau und Eigenschaften
-
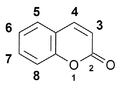
Nummerierung des Heterocyclen Cumarin.
Die am häufigsten verwendeten Cumarin-Farbstoffe sind die 7-Aminocumarine. Diese besitzen eine Aminogruppe an der C-7 Position, wobei die Zählweise der Kohlenstoffatome des sechsgliedrigen Doppelring-Heterocyclen am Sauerstoff-Heteroatom des 2-Pyron beginnt (siehe rechte Graphik oben).
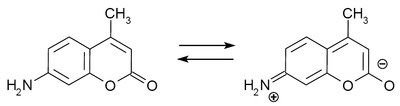
Durch ein intramolekularen Ladungstransfer (engl. intramolecular charge-transfer, ICT) von der als Elektronendonatorgruppe (engl. electron donating group, EDG) fungierenden Aminogruppe zur Carbonylgruppe des 2-Pyron, bzw. zu einer zusätzlich vorhandenen Elektronenakzeptorgruppe (engl. electron withdrawing group, EWG) an der C-3 bzw. C-4 Position, erhalten diese Cumarin-Farbstoffe ihre spezifischen photophysikalischen Eigenschaften.[1] Die 7-Aminocumarine können prinzipiell durch zwei mesomere Zustände beschrieben werden. Ein unpolarer Zustand, welcher im S0 Grundzustand überwiegt und ein geringes elektrisches Dipolmoment besitzt, und ein polarer Zustand bei dem eine positive Ladung am Stickstoffatom und eine negative am 2-Pyron lokalisiert ist. Dieser Zustand besitzt ein erhöhtes Dipolmoment und ist im angeregten Zustand S1 überwiegend vorherrschend. Im Folgenden sind am Beispiel von Cumarin 120 die beiden möglichen mesomeren Zustände wiedergegeben:[2]
Der Bereich der Lichtabsorption von Cumarin-Farbstoffen (7-Aminocumarine) erstreckt sich vom nahen UV (UV-A) bis in den blauen Spektralbereich, wobei die Emission der Fluoreszenz im blauen bis grün-gelben Spektralbereich liegt. Die photophysikalischen Eigenschaften hängen stark vom verwendeten Lösungsmittel ab. So wird z. B. der mesomere Zustand mit dem hohen Dipolmoment durch polare Lösungsmittel mehr stabilisiert, was typischerweise eine Rotverschiebung der Absorption bei den Cumarin-Farbstoffen verursacht. Weiterhin wird durch optische Anregung des S1 Niveaus eine Neuausrichtung von polaren Lösungsmittelmolekülen verursacht, was die Energie des angeregten Zustandes senkt und eine Rotverschiebung der Emission zur Folge hat. Diese fällt stärker aus als die Rotverschiebung der Absorption und erhöht somit die Stokes-Shift.[2][3][4]
Die als Laserfarbstoff eingesetzte Cumarine besitzen eine sehr hohe Quantenausbeute in unpolaren Lösungsmitteln, welche typischer Weise mit steigender Polarität des Lösungsmittels sinkt. Bei Cumarin-Farbstoffen mit starren Seitenketten am Stickstoffatom ist die Abnahme der Quantenausbeute nicht so stark ausgeprägt, da die frei rotationsfähigen Seitenketten konkurrierende nichtstrahlende Übergänge in den S0 Grundzustand begünstigen können.[5] Des Weiteren ist die Wahrscheinlichkeit eines Spinflips (vom Singulettzustand in den Triplettzustand) sehr gering, so dass Cumarine sich nur selten im langlebigen Triplettzustand befinden, in dem sie nicht fluoreszieren.
Übersicht häufig eingesetzter Cumarin-Farbstoffe
Eine Auswahl häufig eingesetzter Cumarin-Farbstoffe zeigt die nachfolgende Tabelle. Angegeben (in Nanometern) ist der ungefähre Emissionsbereich für verschiedene Lösungsmittel, sowie das Absorptions- und Emissionsmaximum exemplarisch für Ethanol.[6]
Name (Alias) λAbs max. in EtOH λEm max. in EtOH Emissionsbereich Cumarin 120 354 435 420 - 470 Cumarin 1 (47; 460) 373 450 440 - 490 Cumarin 102 (480) 389 465 450 - 510 Cumarin 307 395 490 480 - 550 Cumarin 152 397 510 490 - 570 Cumarin 153 (540A) 423 530 520 - 590 Cumarin 6 458 505 500 - 560 Die kommerziell erhältlichen Fluoreszenzfarbstoffe bzw. -label Alexa Fluor 350 und 430 (Molecular Probes / Invitrogen Corp.), sowie ATTO 390 und 425 (ATTO-TEC GmbH, Siegen) sind auch Coumarinderivate und finden u. a. häufig Verwendung in der Fluoreszenzmikroskopie.[2]
Siehe auch
Literatur
- Ulrich Brackmann: Lambdachrome: Laser Dyes. 3 Auflage. Lamda Physik AG, Göttingen 2000.
- Alexander P. Demchenko (Hrsg.): Advanced Fluorescence Reporters in Chemistry and Biology I: Fundamentals and Molecular Design (Springer Series on Fluorescence). Springer, Berlin, Heidelberg 2010, ISBN 978-3642047008, S. 150ff.. (E. Kim and S.B. Park: Discovery of New Fluorescent Dyes: Targeted Synthesis or Combinatorial Approach? PDF)
- M. Sauer, J. Hofkens, J. Enderlein: Handbook of Fluorescence Spectroscopy and Imaging: From Single Molecules to Ensembles: From Ensemble to Single Molecules. Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2011, ISBN 978-3527316694, S. 39ff..
Einzelnachweise
- ↑ Alexander P. Demchenko (Hrsg.): Advanced Fluorescence Reporters in Chemistry and Biology I: Fundamentals and Molecular Design (Springer Series on Fluorescence). Springer, Berlin, Heidelberg 2010, ISBN 978-3642047008, S. 150ff.. (E. Kim and S.B. Park: Discovery of New Fluorescent Dyes: Targeted Synthesis or Combinatorial Approach? PDF)
- ↑ a b c M. Sauer, J. Hofkens, J. Enderlein: Handbook of Fluorescence Spectroscopy and Imaging: From Single Molecules to Ensembles: From Ensemble to Single Molecules. Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2011, ISBN 978-3527316694, S. 39ff. (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ Brian D. Wagner: The Use of Coumarins as Environmentally-Sensitive Fluorescent Probes of Heterogeneous Inclusion Systems. In: Molecules. Vol. 14, 2009, Seiten 210-237. (PDF)
- ↑ Sanjukta Nad, Manoj Kumbhakar, Haridas Pal: Photophysical Properties of Coumarin-152 and Coumarin-481 Dyes: Unusual Behavior in Nonpolar and in Higher Polarity Solvents. In: J. Phys. Chem. A. Vol. 107 (24), 2003, Seiten 4808–4816. (PDF)
- ↑ G.A. Reynolds, K.H. Drexhage: New coumarin dyes with rigidized structure for flashlamp-pumped dye lasers. In: Optics Communications. Vol. 13, No. 3, 1975, Seiten 222-225. (PDF)
- ↑ Ulrich Brackmann: Lambdachrome: Laser Dyes. 3 Auflage. Lamda Physik AG, Göttingen 2000.
-
Wikimedia Foundation.