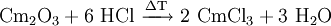- Curiumtrichlorid
-
Kristallstruktur 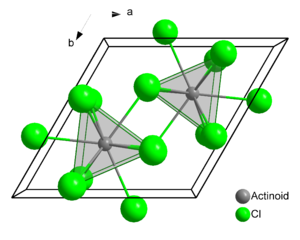
Kristallsystem hexagonal Raumgruppe 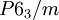
Gitterkonstanten a = 726 pm
c = 414 pmKoordinationszahlen Cm[9], Cl[3] Allgemeines Name Curium(III)-chlorid Andere Namen Curiumtrichlorid
Verhältnisformel CmCl3 CAS-Nummer 13537-20-7 Kurzbeschreibung farbloser Feststoff[1] Eigenschaften Molare Masse je nach Isotop: 344–358 g/mol Aggregatzustand fest
Schmelzpunkt Löslichkeit schlecht in Wasser
Sicherheitshinweise Gefahrstoffkennzeichnung [3] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Radioaktivität 
RadioaktivSoweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Curium(III)-chlorid ist ein Curiumsalz der Salzsäure und gehört daher zur Stoffklasse der Chloride. Es ist ein farbloser, kristalliner Feststoff mit der chemischen Formel CmCl3. Da von dem Element Curium keine stabilen Isotope existieren, ist die Verbindung radioaktiv.
Inhaltsverzeichnis
Vorkommen
Da es keine natürlichen Curiumvorkommen gibt, kann diese Verbindung nur synthetisch dargestellt werden.
Darstellung
Curium(III)-chlorid kann aus der Reaktion von Curium(III)-oxid oder Curium(III)-hypochlorit mit wasserfreiem Chlorwasserstoff bei 400–600 °C hergestellt werden.[4]
Eigenschaften
Curium(III)-chlorid ist eine farblose und in Wasser schlecht lösliche Ionenverbindung bestehend aus Cm3+- und Cl−-Ionen. Es kristallisiert im hexagonalen Kristallsystem in der Raumgruppe P63/m mit den Gitterparametern a = 726 pm und c = 414 pm und zwei Formeleinheiten pro Elementarzelle.[5] Seine Kristallstruktur ist isotyp mit Uran(III)-chlorid. In der Struktur werden die Curiumatome von je neun Chloratomen umgeben, als Koordinationspolyeder ergibt sich dabei ein dreifach überkapptes, trigonales Prisma. Die Cm-Cl-Bindungslängen betragen 260 und 291 pm.[1] Der Schmelzpunkt der Verbindung liegt bei 695 °C.
Verwendung
Curium(III)-chlorid findet Anwendung in der Actinoidforschung. Das Salz kann als Ausgangsverbindung zur Herstellung von Curium(III)-Komplexen mit Chloroliganden dienen.
Quellen
- ↑ a b Morrs, Edelstein, Fuger, The Chemistry of the Actinide and Transactinide Elements: Bd. 3, 2006, Springer.
- ↑ J. R. Peterson, J. H. Burns: "Single Crystal and Powder Diffraction Studies of Curium-248 Trichloride, 248CmCl3", in: J. Inorg. Nucl. Chem. 1973, 35, 1525–1530; doi:10.1016/0022-1902(73)80241-6.
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ J. C. Wallmann, J. Fuger, J. R. Peterson, J. L. Green: "Crystal Structure and Lattice Parameters of Curium Trichloride", in: J. Inorg. Nucl. Chem. 1967, 29, 2745–2751; doi:10.1016/0022-1902(67)80013-7.
- ↑ V. Milman, B. Winkler, C. J. Pickard: "Crystal structures of curium compounds: an ab initio study", in: Journal of Nuclear Materials 2003, 322, 165–179; doi:10.1016/S0022-3115(03)00321-0.
Wikimedia Foundation.