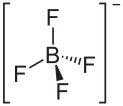
- Cyclisches Ion
- Dieser Artikel befasst sich mit dem Begriff Ion aus der Chemie und Physik; für andere Bedeutungen siehe Ion (Begriffsklärung).
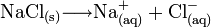
- Na+ – Natrium-Ion (n wird hier weggelassen, da n gleich eins ist)
- S2− – Sulfid-Ion
- NH4+ – Ammonium-Ion, ein zusammengesetztes Ion
Ein Ion [i̯oːn] (von altgr. ἰών bzw. ἰόν ión, „gehend“) ist ein elektrisch geladenes Atom oder Molekül. Es enthält mindestens einen einfach positiv geladenen Atomkern. Dessen oder deren Ladung entspricht der Zahl der enthaltenen Protonen. Daneben kann ein Ion Elektronen enthalten. Die nach außen wirksame, beobachtbare Ladung des Ions entsteht durch die unterschiedlichen Anzahlen von Protonen und Elektronen. Ionen sind durch Elektronenmangel positiv oder durch Elektronenüberschuss negativ geladen.
Schnelle Ionen, die sich in einer Richtung bewegen, werden in der Atomphysik, Kernphysik und Teilchenphysik untersucht oder verwendet, siehe Ionenstrahlung, Ionenquelle oder Teilchenbeschleuniger. Ein Plasma (z. B. im Innern der Sterne) ist ein ungeordnetes Ensemble aus schnellen Ionen und Elektronen, die sich bei hoher Temperatur in allen Richtungen bewegen, wie die Moleküle eines Gases.
Die folgenden Ausführungen beziehen sich im wesentlichen auf langsame oder stationäre Ionen.
Positiv geladene Ionen werden Kationen, negativ geladene Anionen genannt, da sie jeweils in einem elektrischen Feld zur Kathode (Minuspol) bzw. zur Anode (Pluspol) wandern. In einem Lösungsmittel bilden sie eine Solvathülle (vgl. Hydrathülle) aus.
Inhaltsverzeichnis |
Bildung von Ionen

Ionen bilden sich aus Atomen, wenn diese Elektronen abgeben oder aufnehmen. Obwohl die Trennung von Ladungen einen Energieaufwand verursacht, können die gebildeten Ionen energetisch günstig sein, wenn sie besonders stabile Konfigurationen haben, zum Beispiel die Oktettregel erfüllen.
Kationen
Positiv geladene Ionen, sog. Kationen, werden gebildet, wenn Atome Elektronen abgeben. Da der Atomkern nach wie vor eine identische positive Ladung besitzt (im neutralen Atom entspricht die Anzahl der Protonen im Kern exakt der Anzahl der ihn umgebenden Elektronen), erscheint das Ion in seiner Gesamtheit als ein positiv geladenes Teilchen.
Beispiel: Metall-Ionen sind in der Regel positiv geladen.
Gleichung für die Natrium-Ionen-Bildung: Na → Na+ + e−
Gleichung für die Magnesium-Ionen-Bildung: Mg → Mg2+ + 2e−
Anionen
Negativ geladene Ionen (Anionen) werden gebildet, indem Atome Elektronen aufnehmen. Dadurch entsteht ein Überschuss an Elektronen (negative Ladungsträger), der durch die vorhandenen Protonen (positive Ladungsträger) nicht mehr ausgeglichen wird – die negativen Ladungen überwiegen, das Ion ist negativ geladen.
Beispiel: Nichtmetall-Ionen sind in der Regel negativ geladen.
Gleichung für die Chlorid-Ionen-Bildung: Cl + e− → Cl−
Gleichung für die Sulfid-Ionen-Bildung: S + 2e− → S2−
Bewegliche Ionen bilden sich spontan, wenn Salze in polaren Lösungsmitteln (Wasser) gelöst werden, z. B.
Der Index „aq“ steht für aquatisiert.
Als Beispiel seien die wässrigen Milieus von Zellen und Organismen (Elektrolytlösung) genannt. Hier spielen sie eine entscheidende Rolle für die elektrischen Vorgänge an Membranen, insbesondere für die Erregbarkeit (Membranpotential, Aktionspotential).
Kennzeichnung
Die Ionenladung gibt an, wie viele positive oder negative elektrische Ladungen ein Ion besitzt. Sie wird durch eine hochgestellte arabische Ziffer mit nachstehendem Plus- oder Minuszeichen angegeben. Die allgemeine Form lautet An− beziehungsweise An+.
Beispiele sind:
Bei komplexen Ionen wird das Molekül in eckige Klammern gesetzt und die Ionenladung hochgestellt hinter der Klammer angegeben.
Eigenschaften der Ionen
Der Radius von Ionen unterscheidet sich von dem des entsprechenden Atoms. Der Kationenradius ist kleiner – aufgrund der Nichtbesetzung der äußeren Orbitale –, der der Anionen meistens größer, da die äußeren Orbitale mit Elektronen aufgefüllt und/oder weitere Orbitale neu besetzt werden. Abhängig vom Verhältnis von Ladung zu Radius wirken Ionen unterschiedlich polarisierend in chemischen Bindungen.
Ionen unterschiedlicher Ladung bilden durch die Ionenbindung Salze. Lösungen, die ionische Substanzen enthalten, leiten elektrischen Strom und heißen daher Elektrolyte.
Ein cyclisches Ion ist ein Ion, das in einer Ringstruktur aufgebaut ist (cyclische Verbindungen).
Vorkommen
Ionen mit mehr als 3 Unter- oder Überschussladungen kommen in der Chemie nur selten vor. In der Physik werden sie zu bestimmten experimentellen Zwecken erzeugt und kommen auch in der Natur vor.
Gasionen spielen bei den Leitungsvorgängen in Leuchtstofflampen und anderen Gasentladungen (elektrische Funken, Blitze) eine Rolle. Ein (fast) vollständig ionisiertes Gas bezeichnet man als Plasma.
Ionisierte Edelgase können Ionenbindungen eingehen. Edelgas-Halogenid-Verbindungen werden in Excimerlasern verwendet.
Bei Molekülen mit zwei oder mehreren funktionellen Gruppen kann es vorkommen, dass sie an einer Gruppe eine positive, an einer anderen eine negative Ladung tragen (insgesamt ist das Molekül dann neutral). Solche polaren Moleküle werden auch als Zwitterionen bezeichnet.
Elektrolyte spielen eine große Rolle in Stoffwechselvorgängen und in Batterien.
Konfiguration
Nach Abgabe oder Aufnahme von Elektronen hat die Valenzelektronen-Schale eine andere Anzahl Elektronen als zuvor. Ist die Anzahl der Elektronen des Ions in allen Schalen gleich der normalen Konstellation eines Edelgasatoms, spricht man von einer „Edelgaskonfiguration“.
Siehe auch
Weblinks
Wikimedia Foundation.