- Estrogenrezeptor
-
Estrogen-Rezeptor, α-Untereinheit —
Masse/Länge Primärstruktur 595 Aminosäuren Sekundär- bis Quartärstruktur Homodimer, Heterodimer Isoformen Long, Short Bezeichner Gen-Name ESR1 Externe IDs OMIM: 133430 UniProt: P03372 Vorkommen Übergeordnetes Taxon mehrzellige Tiere Estrogen-Rezeptor, β-Untereinheit —
Masse/Länge Primärstruktur 530 Aminosäuren Sekundär- bis Quartärstruktur Homodimer, Heterodimer Isoformen 8 Bezeichner Gen-Name ESR2 Externe IDs OMIM: 601663 UniProt: Q92731 Vorkommen Übergeordnetes Taxon Säugetiere Estrogenrezeptoren (ER) sind Steroidrezeptoren, die zur Superfamilie der nukleären Rezeptoren NR3I (nuclear receptor subfamily 3, group I) zählen und durch das Steroidhormon Estrogen aktiviert werden.[1] Die wichtigste Funktion des Estrogenrezeptor ist ein DNA-bindender Transkriptionsfaktor, der die Genexpression des Zielgens reguliert. Der Estrogenrezeptor hat jedoch noch zusätzliche Funktionen unabhängig von der DNA-Bindung.[2]
Struktur und Bindung
Zwei humane Rezeptorsubtypen konnten identifiziert werden, die beide die gleiche Grundstruktur besitzen:
- Estrogenrezeptor-α (ERα, NR3A1)
- Estrogenrezeptor-β (ERβ, NR3A2)
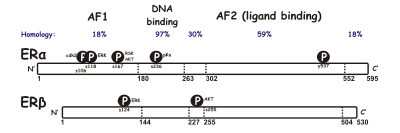
Beide Rezeptoren besitzen sechs Domänen (A-F):
- A/B-Domäne: Enthält eine ligandenunabhängige transkriptionelle Aktivierungsfunktion (AF-1).
- C-Domäne: DNA-Bindungsdomäne (DBD). Sie enthält zwei Zinkfingermotive.
- D-Domäne: Dimerisierungsregion.
- E/F-Domäne: Enthält die Ligandenbindungsdomäne (LBD) und eine sogenannte Transaktivierungsregion am C-Terminus (AF-2).
Da beide Subtypen in vielen Zellen gleichzeitig exprimiert werden, kommt es bei der hormonaktivierten Rezeptordimerisierung zur Bildung von ERα (αα) bzw. ERβ (ββ) Homodimeren oder ERαβ (αβ) Heterodimeren.
Unterschiedliche Liganden können sich in ihrer Affinität hinsichtlich der beiden Rezeptorisoformen unterscheiden:[3]
- Estradiol und Coumestrol bindet an beide Rezeptoren
- Estron und Raloxifen binden vorzugsweise an ERα
- Estriol und Genistein binden an ERβ
Selektive Estrogenrezeptormodulatoren binden vorzugsweise entweder an den α- oder β-Subtyp des Rezeptors.
Einzelnachweise
- ↑ Dahlman-Wright, K. et al. (2006): International Union of Pharmacology. LXIV. Estrogen receptors. In: Pharmacol. Rev. 58(4):773-781. PMID 17132854 PDF
- ↑ Levin, E.R. (2005): Integration of the extranuclear and nuclear actions of estrogen. In: Mol. Endocrinol. 19(8):1951-1959. PMID 15705661 doi:10.1210/me.2004-0390
- ↑ Morito K, Aomori T, Hirose T, et al: Interaction of phytoestrogens with estrogen receptors alpha and beta (II). In: Biol. Pharm. Bull.. 25, Nr. 1, Januar 2002, S. 48–52. PMID 11824555.
Weblinks
- Jennifer McDowall/Interpro: Protein Of The Month: Oestrogen receptors. (engl.)
- Orphanet: Estrogen resistance syndrome.
Wikimedia Foundation.