- Gabax
-
Strukturformel 
Allgemeines Freiname Gabapentin Andere Namen 1-(Aminomethyl)cyclohexylessigsäure
Summenformel - C9H17NO2 (Gabapentin)
- C9H17NO2·HCl (Gabapentin·Hydrochlorid)
CAS-Nummer - 60142-96-3 (Gabapentin)
- 60142-95-2 (Gabapentin·Hydrochlorid)
PubChem 3446 ATC-Code N03AX12
DrugBank DB00996 Arzneistoffangaben Wirkstoffklasse Fertigpräparate Verschreibungspflichtig: Ja Eigenschaften Molare Masse - 171,24 g·mol−1 (Gabapentin)
- 207,70 g·mol−1 (Gabapentin·Hydrochlorid)
Schmelzpunkt 162–166 °C bzw. 165–167 °C [1]
Sicherheitshinweise Gefahrstoffkennzeichnung [2]
T
GiftigR- und S-Sätze R: 61-36/37/38 S: 53-26-36/37/39-45 Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln WGK 3 (stark wassergefährdend) [2] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Gabapentin ist ein Arzneistoff aus der Gruppe der Antikonvulsiva, der zur Behandlung der Epilepsie und neuropathischer Schmerzen eingesetzt wird. Es wird in Deutschland unter den Handelsnamen Neurontin oder Gabax® vertrieben und unter generischer Bezeichnung angeboten. Gabapentin wurde 1976 von Gödecke und Warner-Lambert patentiert.
Inhaltsverzeichnis
Pharmakologie
Anwendungsgebiete
Gabapentin ist zur Monotherapie von einfachen und komplexen partiellen Anfällen mit und ohne sekundäre Generalisierung und zur Zusatztherapie von partiellen Anfällen mit und ohne sekundäre Generalisierung zugelassen. Eine weitere Indikation ist die Behandlung neuropathischer Schmerzen. Neuropathische Schmerzen entstehen z.B. bei einem Teil der Patienten mit einer Gürtelrose nach Abklingen der Hautveränderungen, der Post Zoster Neuralgie. Ein anderes häufiges Anwendungsgebiet ist die diabetische Polyneuropathie sowie die Behandlung von Phantomschmerzen. Auch postoperative Schmerzen können durch Gabapentin gemildert werden.[3]
Wirkmechanismus
Der Wirkmechanismus von Gabapentin ist noch nicht vollständig geklärt. Seine antikonvulsive Wirkung wird nicht mit einer direkten Aktivierung von GABA-Rezeptoren in Verbindung gebracht. Diskutiert wird eine Hemmung der glutamatergen Erregungsübertragung.
Nebenwirkungen (Auszug)
Die häufigsten Nebenwirkungen während der Anwendung von Gabapentin sind Müdigkeit, Schwindel, Kopfschmerzen, Übelkeit, Erbrechen, Gewichtszunahme, Nervosität, Schlaflosigkeit, Ataxie, Augenzittern, Parästhesien, gesteigerter Appetit aber auch Appetitlosigkeit und Anorexie. Des Weiteren können Mittelohrentzündung, Virus- und Atemwegsinfektionen, Leuko- und Thrombozytopenie, aber auch psychische Auffälligkeiten wie Angst, Depressionen, Halluzinationen, Denkstörungen, Feindseligkeit, Amnesie und Verwirrtheit auftreten.[4]
Wechselwirkungen
Die Resorption von Gabapentin kann durch gleichzeitige Einnahme von calcium- oder magnesiumhaltigen Antacida beeinflusst werden. Morphin und Alkohol können die Wirkungen und Nebenwirkungen von Gabapentin verstärken.
Gabapentin kann das Ergebnis einiger Urintests auf Eiweiß falsch-positiv beeinflussen.
Verabreichung
Das Medikament wird oral aufgenommen, der Wirkstoff verbleibt mit einer Halbwertszeit von 5 bis 7 Stunden im Blut. Ausgeschieden wird es über den Harn.
Physikalische und chemische Eigenschaften
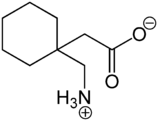
Gabapentin ist ein Analogon der γ-Aminobuttersäure (GABA). Es liegt überwiegend als „inneres Salz“ bzw. Zwitterion vor, dessen Bildung dadurch zu erklären ist, dass das Proton der Carboxylgruppe an das einsame Elektronenpaar des Stickstoffatoms der Aminogruppe wandert.
Zwitterionen-Form des Gabapentind
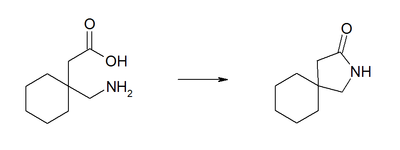
Im elektrischen Feld wandert das Zwitterion nicht, da es als Ganzes ungeladen ist. Genaugenommen ist dies am isoelektrischen Punkt (bei einem bestimmten pH-Wert) der Fall, bei dem das Gabapentin auch seine geringste Löslichkeit in Wasser hat.Die Verbindung neigt zu einer intramolekularen Lactambildung.[5][6] Als Verunreinigung infolge der Herstellung oder Lagerung sollte das Lactam im pharmazeutischen Produkt vermieden werden, da dieses möglicherweise toxischer als Gabapentin ist.[7]
Synthese
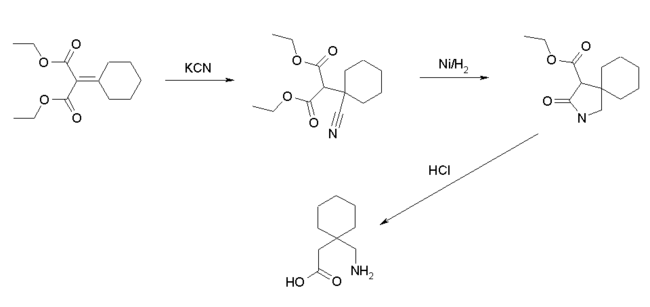
Gabapentin kann in drei Reaktionsschritten aus 2-Cyclohexylidenmalonsäurediethylester hergestellt werden.[8] Dabei wird zunächst durch Umsetzung mit Cyanid der 2-Cyclohexyl-2-cyanomalonsäurediethylester erhalten. Durch eine anschließende reduktive Cyclisierung ergibt sich eine Lactamzwischenverbindung, die unter sauren Bedingungen zum Gabapentin verkocht wird.
Einzelnachweise
- ↑ The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage, 2006, S. 742, ISBN 978-0-911910-00-1.
- ↑ a b Angaben des Herstellers Sigma-Aldrich, 21. Juli 2008.
- ↑ Mathiesen O, Møiniche S, Dahl JB (2007): Gabapentin and postoperative pain: a qualitative and quantitative systematic review, with focus on procedure. In: BMC Anesthesiol. 7:6. PMID 17617920 doi:10.1186/1471-2253-7-6
- ↑ Rote Liste - Online
- ↑ B. Ciavarella, A. Cupta, V.A. Sayeed, M.A. Khan, P.J. Faustino: Development and application of a validated HPLC method for the determination of gabapentin and its major degradation impurity in drug product in J. Pharm. Biomed. Anal 43 (2007) 1647-1653 doi:10.1016/j.jpba.2006.12.020
- ↑ Cheng-Hung Hsua, Shan-Yang Li: Rapid examination of the kinetic process of intramolecular lactamization of gabapentin using DSC–FTIR in Thermochim. Acta 486 (2009) 5-10 doi:10.1016/j.tca.2008.12.008
- ↑ H. Potschka, T.J. Feuerstein, W. Löscher: Gabapentin-lactam, a close analogue of the anticonvulsant gabapentin, exerts convulsant activity in amygdala kindled rats in Arch. Pharmacol. 361 (2000) 200-265 doi:10.1007/s002109900174
- ↑ G. Griffiths, H. Mettler, L.S. Mills, F. Previdoli: Novel Syntheses of Gabapentin via Addition of Hydrocyanic Acid to Cyclohexylidenemalonate or Cyano(cyclohexylidene)acetate in Helv. Chim. Acta 74 (1991) 309-314 doi:10.1002/hlca.19910740208
Siehe auch
Bitte beachte den Hinweis zu Gesundheitsthemen!
Wikimedia Foundation.