- Haber-Bosch-Verfahren
-
Das Haber-Bosch-Verfahren dient zur industriellen Herstellung von Ammoniak aus den Elementen Stickstoff und Wasserstoff und ist nach seinen Entwicklern Fritz Haber und Carl Bosch benannt.
Nach diesem Verfahren wird mit 100 Millionen Tonnen der Großteil des jährlich produzierten Ammoniaks erzeugt. Aufgrund des hohen Energiebedarfs bei der Herstellung des benötigten reinen Wasserstoffs entfallen etwa 1,4 % des Weltenergieverbrauchs auf das Haber-Bosch-Verfahren.
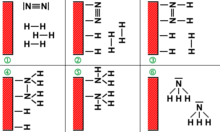
Beim Haber-Bosch-Verfahren wird ein Gasgemisch aus Wasserstoff und Stickstoff an einem Eisenoxid-Mischkatalysator aus Eisen(II/III)-Oxid Fe3O4, K2O, CaO, Al2O3 und SiO2 bei etwa 300 bar Druck und 450 °C zur Reaktion gebracht. Der eigentliche Katalysator α-Fe entsteht erst im Reaktor durch die Reduktion des Fe3O4 durch den Wasserstoff.
Im Zusammenhang mit dem Haber-Bosch-Verfahren wurden bereits mehrere Nobelpreise für Chemie vergeben: An Fritz Haber 1918 und Carl Bosch 1931 (zusammen mit Friedrich Bergius) sowie an Gerhard Ertl 2007, unter anderem für die vollständige theoretische Erklärung des Mechanismus.
Geschichte und Bedeutung
Die wesentlichen wissenschaftlichen Leistungen zur Realisierung dieses Verfahrens waren zum einen die Untersuchung der zugrunde liegenden chemischen Reaktion durch Fritz Haber und Walther Nernst, zum anderen die systematische Suche nach geeigneten Katalysatoren durch Alwin Mittasch. Für die technische Realisierung im großen Maßstab wurden durch Carl Bosch und Fritz Haber vollkommen neue Lösungen in vielen Bereichen der Technischen Chemie und des Reaktorbaus entwickelt.
Das Haber-Bosch-Verfahren wurde durch die BASF im Jahr 1910 zum Patent angemeldet, ein zuvor eingereichtes, fehlerhaftes Patent von Haber zum selben Thema wurde gleichzeitig zurückgezogen.[1] Großanlagen wurden unter anderem in Ludwigshafen-Oppau, Leuna und Bitterfeld durch die BASF und nach Fusion im deutschen Großkonzern der I.G. Farben betrieben. Der erste zur Produktion eingesetzte Hochdruck-Reaktor ist heute noch im Original erhalten und kann im öffentlichen Park vor dem BASF-Kasino in Ludwigshafen besichtigt werden.
Ammoniak kann beispielsweise durch Reaktion mit Kohlenstoffdioxid (CO2) zu Harnstoff, der als Düngemittel verwendet wird, oder im Ostwaldverfahren zu Salpetersäure weiterverarbeitet werden. Von militärischer Bedeutung ist Ammoniumnitrat (Salpeter), ein Produkt aus Ammoniak und Salpetersäure, zur Herstellung von Sprengstoff, daher wurde die Weiterentwicklung des Verfahrens bis zur großindustriellen Anwendbarkeit 1914 auf Druck des deutschen Generalstabsschefs Erich von Falkenhayn forciert. Als das Deutsche Reich während des Ersten Weltkriegs durch die alliierte Seeblockade von natürlichen Stickstoffquellen (Chilesalpeter) abgeschnitten war, gelang es nur mit Hilfe des Haber-Bosch-Verfahrens den schon Ende 1914 drohenden Zusammenbruch der deutschen Munitionsproduktion abzuwenden und auch die Düngemittelproduktion aufrechtzuerhalten.
Die Verfügbarkeit großer Mengen an Stickstoffdünger gab Anlass für umfangreiche landwirtschaftliche Forschungen, in denen die verwendeten Düngermengen je nach Boden und Pflanzenart optimiert wurden (Minimum-Tonne). Durch großflächigen Düngemitteleinsatz konnte die weltweite landwirtschaftliche Produktion deutlich gesteigert werden.
Harnstoff ist auch für den Umweltschutz von Bedeutung: Die in Verbrennungsgasen enthaltenen schädlichen Stickoxide lassen sich mit Harnstoff über Selektive nicht-katalytische Reduktion und Selektive katalytische Reduktion zu unschädlichem Stickstoff reduzieren. Heutzutage hat, zumindest in Industrienationen, ca. 40 % des im menschlichen Körper enthaltenen Stickstoffs schon einmal an der Haber-Bosch-Synthese teilgenommen.
Synthesebedingungen
 Der 1921 gebaute Ammoniak-Reaktor der Badischen Anilin- und Sodafabrik befindet sich heute auf dem Gelände des Karlsruher Instituts für Technologie
Der 1921 gebaute Ammoniak-Reaktor der Badischen Anilin- und Sodafabrik befindet sich heute auf dem Gelände des Karlsruher Instituts für Technologie
Die Ammoniaksynthese findet heute unter folgenden Reaktionsparametern statt:[2]
- Mengenverhältnis Stickstoff zu Wasserstoff = 1 : 3
- Druck: 250 bar bis 350 bar
- Temperatur: 450–550 °C (der Zerfall des Ammoniaks und die Wirksamkeit des Katalysators steigen mit der Temperatur an; hier liegt das Optimum)
- Verwendung von α-Eisen als Katalysator, welches durch Reduktion aus Eisen(II/III)-Oxid Fe3O4 und K2O, CaO, Al2O3 und SiO2 als Promotoren gewonnen wird.
Durch den Katalysator wird die Aktivierungsbarriere für die Spaltung der Dreifachbindung des Stickstoffmoleküls zwar stark abgesenkt, dennoch sind immer noch hohe Temperaturen für eine angemessene Reaktionsgeschwindigkeit erforderlich. Weil die Gesamtreaktion exotherm ist (Bildung von 2 NH3: ΔH0= -92,5 kJ/mol) führt die hohe Temperatur zu einer Verschiebung des Gleichgewichts zu den Edukten und verringert deshalb die Ausbeute (Prinzip von Le Chatelier). Da die Reaktion unter Volumenverminderung abläuft, führt der hohe Arbeitsdruck zu einer Erhöhung der Ausbeute. Zudem entfernt man das gebildete Ammoniak laufend aus dem Reaktionssystem.
Der Volumenanteil NH3 im Gasgemisch beträgt rund 17,6 %.
Der für die Reaktion nötige Wasserstoff wird heute meist durch die partielle Oxidation von Erdgas erschlossen, der Stickstoff wird wie schon im ursprünglichen Verfahren direkt aus der Luft entnommen. Der störende Luft-Sauerstoff wurde früher durch Reduktion mit Wasserstoff zu Wasser umgesetzt und so abgeschieden. Inzwischen ist die Luftzerlegung durch Fraktionierung von flüssiger Luft wirtschaftlicher.
Moderne Ammoniakanlagen erzeugen mehr als 3.000 Tonnen pro Tag in einer Produktionslinie.
Technische Herstellung von Ammoniak
Ammoniak entsteht in einer Gleichgewichtsreaktion aus den Elementen Wasserstoff und Stickstoff. Hierzu werden benötigt:
- N2 aus der Luft
- H2 aus Methangas (CH4) und Wasserdampf
1. Schritt: Spaltgaserzeugung
In einem ersten Schritt wird Wasserstoff vom Kohlenstoff getrennt. Dazu lässt man Methan mit Wasserdampf, mit Hilfe eines Katalysators (Nickeloxid-Aluminiumoxid-Katalysator), zu Kohlenstoffmonoxid und Wasserstoff reagieren (Primärreformer).
 ΔH = + 206kJ / mol
ΔH = + 206kJ / mol
2. Schritt: Sekundärreformer
Da die obige Reaktion das Methangas nur unvollkommen umsetzt, lässt man in einem zweiten Schritt das restliche Methangas mit Sauerstoff zu Kohlenstoffmonoxid und Wasserstoff reagieren (Sekundärreformer). Der Sekundärreformer wird hierzu mit Luft beschickt, wobei der für die spätere Ammoniaksynthese erforderliche Stickstoff automatisch in das Gasgemisch kommt.
 ΔH = − 71kJ / mol
ΔH = − 71kJ / mol
3. Schritt: Konvertieren (Oxidieren) des Kohlenstoffmonoxids zu Kohlenstoffdioxid
In einem letzten Schritt muss das Kohlenstoffmonoxid zu Kohlenstoffdioxid oxidieren (Konvertierung):
 ΔH = − 41kJ / mol
ΔH = − 41kJ / mol
Kohlenstoffmonoxid und Kohlenstoffdioxid bilden mit Ammoniak Feststoffe (Carbamate), die in kurzer Zeit Rohrleitungen und Apparate verstopfen würden. Im folgenden Prozessschritt muss daher das Kohlenstoffdioxid aus dem Gasgemisch entfernt werden.
4. Schritt: Absorption von Kohlenstoffdioxid (Gaswäsche)
Im Gegensatz zu Kohlenstoffmonoxid kann Kohlenstoffdioxid durch eine Gaswäsche leicht aus dem Gasgemisch entfernt werden. Kohlenstoffdioxid wird durch Waschen mit Triethanolamin aus dem Gemisch entfernt.
5. Schritt: Umsetzung des Synthesegases zu Ammoniakgas
Im letzten, entscheidenden Schritt wird das so erzeugte Wasserstoff-Stickstoff-Gemisch bei Hochdruck und etwa 450 °C katalytisch zu Ammoniakgas umgesetzt.
Alternative Verfahren
Das oben beschriebene Steamreforming-Verfahren zur Gewinnung von Synthesegas ist das am häufigsten angewendete. Andere mögliche Verfahren sind:
Partielle Oxidation
Dabei werden Steinkohle oder Kohlenwasserstoffe mit Sauerstoff und Wasserdampf in einem offenen Reaktor ohne Katalysator bei ca. 1100 °C vergast und das Synthesegas wie beim Steamreforming weiterverarbeitet. Stickstoff wird vor Eintritt in die Ammoniaksynthese in stöchiometrischer Menge zudosiert.
Elektrolyse von Wasser
Hierdurch wird mit hohem Aufwand an elektrischer Energie Wasser in H2 und O2 zerlegt. Stickstoff wird dem so gewonnenen Wasserstoff in stöchiometrischer Menge zudosiert. Dieses Verfahren ist nur wirtschaftlich, wenn billige elektrische Energie z. B. aus Wasserkraft zur Verfügung steht, für die es keine andere Verwendung gibt.
Wassergaserzeugung
Wasserstoff wird über die Reaktion von Wasserdampf mit glühendem Koks (siehe Wassergas) hergestellt. Dabei wird Luft zugeführt, jedoch nur soviel, dass der Sauerstoff vollständig verbraucht wird, wobei Kohlenstoffmonoxid entsteht. Der für die spätere Ammoniaksynthese erforderliche Stickstoff verbleibt im Wassergas. Anschließend wird das Kohlenstoffmonoxid wie bereits oben beschrieben mittels Konvertierung in leicht zu entfernendes Kohlenstoffdioxid umgewandelt. Dieses Verfahren hat nur noch historische Bedeutung.
Großtechnische Anwendung
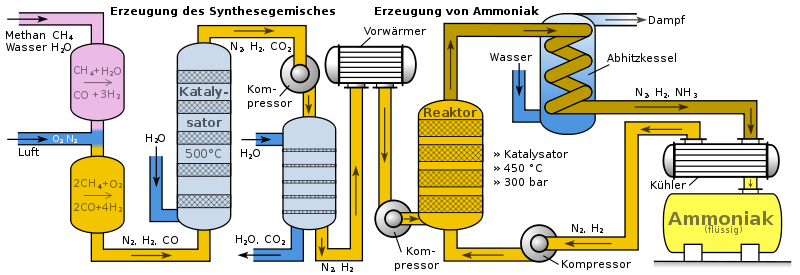
Das Haber-Bosch-Verfahren wird industriell in großen Anlagen angewendet, um preiswert Ammoniak zu gewinnen. Das Schema zeigt den Aufbau einer solchen Anlage und ist von links nach rechts zu lesen:
- Links oben wird Methan und Wasserdampf in den sogenannten Primärreformer eingeleitet, dort entsteht bereits ein Teil des Wasserstoffes.
- Links mittig wird Luft eingeleitet, die zu 21 Prozentteilen aus Sauerstoff und 79 Prozentteilen aus Stickstoff besteht. Durch den Luftsauerstoff entsteht weiterer Wasserstoff.
- Das im entstandenen Gemisch enthaltene Kohlenmonoxid wird in dem ersten grau-blau gezeichneten Reaktor mit Wasserdampf in Gegenwart eines Katalysators zu Kohlendioxid umgesetzt.
- Im Waschturm reagiert das Kohlendioxid unter Druck mit Calciumcarbonat in wässeriger Lösung und wird so von den gewünschten gasförmigen Reaktionsedukten Wasserstoff und Stickstoff getrennt (eine andere mögliche Waschflüssigkeit ist z. B. Triethanolamin).
- Anschließend werden die Reaktionsedukte auf die Zustände im eigentlichen Reaktionsreaktor vorbereitet, in dem sie auf 450 °C hochgeheizt und auf 300 bar komprimiert werden.
- Im mittig gezeichneten Reaktionsreaktor findet die eigentliche Herstellung von Ammoniak statt.
- Die Reaktionsprodukte werden für eine maximale Ausbeute laufend entfernt. Sie werden von 450 °C heruntergekühlt und das erzeugte Ammoniak kondensiert aus. Die noch nicht reagierten Produkte Stickstoff und Wasserstoff werden, um das Frischgas ergänzt, im Kreislauf wieder dem Reaktor zugeführt.
Siehe auch
Literatur
- Gerhard Ertl: Elementarschritte bei der heterogenen Katalyse, Angewandte Chemie 102 (11), S. 1258–1266 (1990). ISSN 0044-8249, doi:10.1002/ange.19901021108.
- Sandro Fehr: Die „Stickstofffrage“ in der deutschen Kriegswirtschaft des Ersten Weltkriegs und die Rolle der neutralen Schweiz. Nordhausen 2009, DNB.
- Alwin Mittasch: Geschichte der Ammoniaksynthese, Verlag Chemie, Weinheim, 1951, 196 Seiten. ASIN B0000BLNJN.
- Robert Schlögl: Katalytische Ammoniaksynthese – eine „unendliche Geschichte“? Angewandte Chemie 115 (18), S. 2050–2055 (2003). ISSN 0044-8249, doi:10.1002/ange.200301553.
Einzelnachweise
Wikimedia Foundation.