- Aliskiren
-
Strukturformel 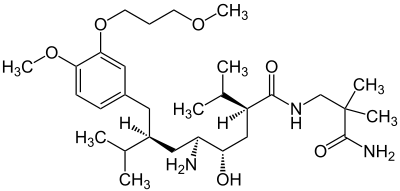
Allgemeines Freiname Aliskiren Andere Namen Summenformel C30H53N3O6 CAS-Nummer 173334-57-1 PubChem 5493444 ATC-Code DrugBank DB01258 Arzneistoffangaben Wirkstoffklasse Wirkmechanismus Verschreibungspflichtig: Ja Eigenschaften Molare Masse 551,76 g·mol−1 Aggregatzustand Feststoff
pKs-Wert 9,49 [1]
Löslichkeit Wasser: > 350 g·l−1 (pH 7,4) [1]
Sicherheitshinweise Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln EU-Gefahrstoffkennzeichnung [2] Keine Einstufung verfügbarR- und S-Sätze R: siehe oben S: siehe oben Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Aliskiren (Hersteller Novartis) wurde im März 2007 von der amerikanischen Arzneimittelzulassungsbehörde (FDA) als erster Arzneistoff aus der Gruppe der oralen, direkten Reninhemmer zur Behandlung der Hypertonie zugelassen.[3] Der Zulassungsantrag bei der Europäischen Arzneimittelagentur wurde von Novartis im Herbst 2006 eingereicht. Basierend auf Daten von über 7.800 Patienten in 44 klinischen Studien hat der Ausschuss für Humanarzneimittel (CHMP) im Juni 2007 den Antrag auf Zulassung des Reninhemmers zur Behandlung der essentiellen Hypertonie positiv bewertet. Daraufhin hat die EU-Kommission am 22. August 2007 die Zulassung für die gesamte EU erteilt.[4] In der Schweiz wurde Aliskiren im Juni 2007 von Swissmedic zur Behandlung der essentiellen Hypertonie in der Abgabekategorie B zugelassen.[5]
Inhaltsverzeichnis
Klinische Angaben
Anwendungsgebiete (Indikationen)
Aliskiren wird oral appliziert und zur Behandlung der essentiellen Hypertonie entweder als Monopräparat oder in Kombination mit Diuretika oder ACE-Hemmern eingesetzt. Die Anwendung in der Pädiatrie und bei Jugendlichen unter 18 Jahren wurde nicht untersucht, und es liegen keine wissenschaftlichen Daten vor.
Art und Dauer der Anwendung
Die ungefähre Eliminationshalbwertszeit von Aliskiren beträgt 40 Stunden. Eine einmalige Einnahme pro Tag ist daher ausreichend. Der gewünschte antihypertensive Effekt wird sich bei den meisten Patienten (85–90 %) nach 2 Wochen Behandlung einstellen. Die Resorption des Arzneistoffs wird durch die Einnahme fettreicher Nahrung stark vermindert.
Gegenanzeigen (Kontraindikationen)
Aliskiren ist kontraindiziert bei einer Überempfindlichkeit gegenüber dem Wirkstoff sowie während der Schwangerschaft oder Stillzeit (siehe unten).
Wechselwirkungen mit anderen Medikamenten
Bei einer Komedikation mit dem harntreibenden Arzneistoff Hydrochlorothiazid kann eine zusätzliche Reduktion des Blutdruckes erreicht werden. Diese Kombination wird als Fertigpräparat Tekturna HCT® 150 mg/12,5 mg (mit 150 mg Aliskiren und 12,5 mg Hydrochlorothiazid) therapeutisch genutzt.[3]
Anwendung während Schwangerschaft und Stillzeit
- Schwangerschaft: Aliskiren kann – wie alle Arzneistoffe, welche direkt am Renin-Angiotensin-Aldosteron-System agieren – schwerwiegende Wirkungen auf die Frucht im Mutterleib während der Fetogenese haben. Die Anwendung während der Schwangerschaft ist deshalb absolut kontraindiziert.
- Stillzeit: Es ist nicht bekannt, ob Aliskiren oder seine Stoffwechselprodukte in die Muttermilch übergehen. Aliskiren wurde allerdings während der Laktation in der Milch von Ratten gefunden. Weil die Folgen und Nebenwirkungen beim Säugling unbekannt sind, muss sich die stillende Mutter überlegen, entweder das Arzneimittel zu nehmen oder sonst abzustillen.
Unerwünschte Wirkungen (Nebenwirkungen)
Aliskiren hat bei therapeutischer Dosierung ein geringes Nebenwirkungsprofil. Die häufigste unerwünschte Wirkung war Diarrhoe (Durchfall) und andere gastrointestinale Beschwerden. Gelegentlich wurden Kopfschmerzen, Übelkeit, Müdigkeit, Infektionen der oberen Atmungsorgane, Rückenschmerzen, Husten und Hautausschläge beobachtet.
Pharmakologische Eigenschaften
Wirkungsmechanismus (Pharmakodynamik)
Aliskiren ist ein neues Antihypertensivum, das im Renin-Angiotensin-Aldosteron-System (RAAS) ganz zu Beginn der Angiotensin-II-Biosynthese angreift. Es bindet direkt an die Protease Renin und verhindert dadurch die Umwandlung von Angiotensinogen in Angiotensin I. Die bei ACE-Hemmern inkomplette Hemmung des Renin-Angiotensin-Aldosteron-Systems wird damit umgangen. Zugleich sinken auch die Angiotensin-II-Spiegel, die unter der Therapie mit AT1-Antagonisten (Sartane) steigen.[6]
Aufnahme und Verteilung im Körper (Pharmakokinetik)
Aliskiren wird nach oraler Einnahme schlecht resorbiert. Die orale Bioverfügbarkeit ist gering und beträgt etwa 2,6 %. Aliskiren hat eine Plasmahalbwertszeit von 40 Stunden. Die maximale Konzentration im Blutplasma Cmax wird in ein bis vier Stunden nach oraler Einnahme erreicht. Das Verteilungsvolumen beträgt 4,2 l/kg. Der steady-state wird bei kontinuierlicher Anwendung nach ca. 7–8 Tagen erreicht. Diese Eigenschaften von Aliskiren sind auch bei älteren Patienten, Diabetikern, Patienten mit renalen und hepatischen Funktionsstörung nicht verändert.
Toxikologie
Es stehen nur begrenzte Daten zur Überdosierung mit Aliskiren beim Menschen zur Verfügung. Der wahrscheinlichste Effekt ist eine Hypotonie (niedriger Blutdruck). Es steht kein Antidot zur Verfügung. Die Therapie besteht in der engmaschigen Überwachung der Vitalfunktionen.
Sonstige Informationen
Chemische und pharmazeutische Informationen
Es wird bei allen galenischen Formen das Salz der Fumarsäure, Aliskirenhemifumarat verwendet.
Beschreibung von Aliskirenhemifumarat[7] Freiname Aliskirenhemifumarat IUPAC-Nomenklatur (2S,4S,5S,7S)-N-(2-Carbamoyl-2-methylpropyl)-5-amino-4-hydroxy-2,7-diisopropyl-8-
[4-methoxy-3-(3-methoxypropoxy)phenyl]-octanamid-hemifumaratSummenformel C32H55N3O8 ChemIDplus Aliskiren bei ChemIDplus Molare Masse 609,80 g·mol−1 Löslichkeit Sehr leicht löslich in Wasser,
Gut löslich in Octanol und PhosphatpufferAggregatzustand Festes, weißes bis hellgelbes kristallines Pulver, welches sehr hygroskopisch ist. Geschichtliches
Die Forschung am RAAS, an Renin und den Reninhemmern ist eine mehr als dreißigjährige Geschichte. Die ersten Arzneimittel waren Peptide, welche – oral appliziert – schon im Verdauungstrakt vor ihrer Resorption zerstört wurden und eine maximale Bioverfügbarkeit von 0,5 % hatten. Das erste marktreife Präparat Pepstatin wurde bereits 1971 vorgestellt. Es hätte parenteral appliziert werden müssen, was kein Patient mit einer Hypertonie angesichts oraler Alternativen akzeptiert hätte. Außerdem waren die ersten Peptid-Reninhemmer nur sehr kurz wirksam, was wegen der mehrmals täglichen Applikation ebenfalls kein konkurrenzfähiges Medikament verheißt. Andere Präparate scheiterten an einer zu geringen Wirkung oder Problemen mit der Verträglichkeit.[8]
Diese Probleme scheinen nun mit Aliskiren weitgehend gelöst zu sein. Es handelt sich um einem nicht-peptidischen, oral wirksamen, direkten Reninhemmer zur Behandlung der arteriellen Hypertonie (hoher Blutdruck). Ciba-Geigy, heute Novartis, entdeckte Aliskiren und patentierte es 1996 unter der US Patent Nr. 5.559.111.[9] Die Firma Speedel, ein in Basel und Bridgewater (USA) angesiedeltes, Biopharmazie-Unternehmen, erwarb die Lizenz an SPP100 (Code-Name für Aliskiren während der Entwicklung) im Jahr 1999 von Novartis und führte in den Phasen I und II mit Erfolg 18 klinische Studien an ca. 500 Patienten sowie gesunden Probanden durch. Basierend auf den während dieses Programms generierten Ergebnissen, übte Novartis im Jahr 2002 eine ihr gewährte Rücklizenz aus und startete danach die klinischen Untersuchungen mit SPP100 in Phase III als Monotherapie gegen Bluthochdruck und in Phase IIb als Kombinationstherapie.
Nutzenbewertung/Stellenwert
Eine über eine Senkung des Blutdruckes hinausgehende positive Wirkung von Aliskiren auf Mortalität und kardiovaskuläre Ereignisse konnte bisher nicht gezeigt werden. Daten zur Sicherheit einer Langzeitbehandlung gibt es nicht. Der therapeutische Stellenwert ist daher fraglich.[10][11]
Handelsnamen
- Enviage (A, GB)
- Rasilez (D, A, CH)
- Riprazo (A)
- Sprimeo (A)
- Tekturna (A, USA)
- Rasilez HCT (A, CH)
- Kombination mit Hydrochlorothiazid[12][13][14]
Literatur
Allgemein
- Hermann J. Roth: Medizinische Chemie : Targets und Arzneistoffe, Dt. Apotheker-Verlag, Stuttgart 2005, ISBN 3-7692-3483-9
- Heinz Lüllmann, Klaus Mohr, Lutz Hein: Pharmakologie und Toxikologie. 16. Auflage. Thieme, Stuttgart 2006, ISBN 3-13-368516-3.
- W. Forth et al.: Allgemeine und spezielle Pharmakologie und Toxikologie. 9. Auflage. Urban & Fischer, München 2005, ISBN 3-437-42521-8.
- Gerhard Thews: Anatomie, Physiologie, Pathophysiologie des Menschen. Wiss. Verlag-Ges., Stuttgart 2007, ISBN 978-3-8047-2342-9
- Patent US5559111.
Studien
- Angiotensin II Suppression in Humans by the Orally Active Renin Inhibitor Aliskiren
- Renin inhibition with aliskiren provides additive antihypertensive efficacy when used in combination with hydrochlorothiazide; PMID 17143194
- Aliskiren, a Novel Orally Effective Renin Inhibitor, Provides Dose-Dependent Antihypertensive Efficacy and Placebo-Like Tolerability in Hypertensive Patients
- Blood Pressure Lowering in Essential Hypertension With an Oral Renin Inhibitor, Aliskiren
- ACE Inhibition Versus Angiotensin Type 1 Receptor Antagonism
- Angiotensin II Suppression in Humans by the Orally Active Renin Inhibitor Aliskiren (SPP100)
- Pharmacologic Demonstration of the Synergistic Effects of a Combination of the Renin Inhibitor Aliskiren and the AT1 Receptor Antagonist Valsartan on the Angiotensin II–Renin Feedback Interruption
- Aliskiren reduces blood pressure and suppresses plasma renin activity in combination with a thiazide diuretic, an angiotensin-converting enzyme inhibitor, or an angiotensin receptor blocker; PMID 17159081.
- Tissue Angiotensin and Pathobiology of Vascular Disease
- Absorption, distribution, metabolism and elimination of the direct renin inhibitor aliskiren in healthy volunteers
Weblinks
- Alle Unterlagen zur Zulassung von Tekturna®bei FDA
- Novartis – Tekturna® Prescribing Information (PDF; 134 kB)
- CARDIOVASC: Renin-Inhibitor Aliskiren, bald Alternative zu ACE-Hemmern und AT1-Antagonisten?
- Chemdrug.com: Synthese von Aliskiren-hemifumarat
- Europäische Arzneimittelagentur: Enviage® Produktinformation (PDF-Datei; 564 kB)
- www.prous.com: Molecule of the Month: Aliskirenfumarate (engl.)
Einzelnachweise
- ↑ a b The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals, 14. Auflage (Merck & Co., Inc.), Whitehouse Station, NJ, USA, 2006; ISBN 978-0-911910-00-1.
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b FDA Approves New Drug Treatment for High Blood Pressure
- ↑ Europäischer Öffentlicher Beurteilungsbericht zu Rasilez®
- ↑ Zulassung von Aliskiren bei Swissmedic
- ↑ American Heart Association, Inc. Aliskiren, a Novel Orally Effective Renin Inhibitor, Provides Dose-Dependent Antihypertensive Efficacy and Placebo-Like Tolerability in Hypertensive Patients.
- ↑ Novartis – Tekturna® Prescribing Information
- ↑ W. Forth, D. Henschler, W. Rummel Allgemeine und spezielle Pharmakologie und Toxikologie, 9. Auflage, URBAN & FISCHER, München, 2005, Seite 458, ISBN 3-437-42521-8.
- ↑ Patent US5559111.
- ↑ Zieschang. Neue Entwicklungen in der Therapie des Bluthochdrucks: Renininhibitoren. AVP 2007(34)1:27.
- ↑ KBV. Wirkstoff aktuell 01/2008.
- ↑ Rote Liste, Stand: August 2009.
- ↑ AM-Komp. d. Schweiz, Stand: August 2009.
- ↑ AGES-PharmMed, Stand: August 2009.

Bitte den Hinweis zu Gesundheitsthemen beachten! Kategorien:- ATC-C09
- Carbonsäureamid
- Phenolether
- Ether
- Beta-Aminoalkohol
- Arzneistoff
- Antihypertensivum
Wikimedia Foundation.
