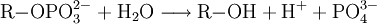- AlkPhos
-
Alkalische Phosphatase —
Bezeichner Externe IDs CAS-Nummer: 9001-78-9 Enzymklassifikation EC, Kategorie 3.1.3.1 Hydrolase Substrat Phosphatmonoester + H2O Produkte Alkohol + Phosphat Alkalische Phosphatase (AP, ALP, knochenspez. auch Ostase) ist der Name für Enzyme, die Phosphorsäureester hydrolysieren. Alkalische Phosphatasen entfernen Phosphat-Gruppen (Dephosphorylierung) von vielen Arten von Molekülen wie Proteinen, Nukleotiden und Alkaloiden. Sie arbeitet am effektivsten bei einem alkalischen pH-Wert.
Alkalische Phosphatasen kommen in fast allen Lebewesen vor, ausgenommen wenige Pflanzen. Ein erhöhter Laborwert beim Menschen deutet auf ein Krankheitsgeschehen, wie Tumor, innere Organschäden oder Knochenbrüche hin.
Inhaltsverzeichnis
Reaktion
Die alkalische Phosphatase hydrolysiert Phosphorsäureester zu Phosphat und Alkoholen, wobei Protonen entstehen.
Dieses Enzym arbeitet nur in schwach alkalischer Lösung. Gäbe man das Enzym zu einer ungepufferten Lösung, so käme die Reaktion wegen der Protonenfreisetzung zum Stillstand. In vitro kann sie also nur in Gegenwart eines Puffers von geeignetem pH-Wert verfolgt werden.
Das humane Enzym
Im Menschen werden 15 verschiedene Isoenzyme unterschieden. Vier dieser Isoenzyme stammen von unterschiedlichen Genen (Dünndarm-AP, Plazenta-AP, Keimzell-AP und Gewebe-unspezifische AP). Die Gewebe-unspezifischen AP werden je nach Gewebe unterschiedlich glykosyliert, d. h. erhält unterschiedliche Zuckerketten. Dadurch entstehen weitere Isoenzyme (Leber-AP, Knochen-AP, Nieren-AP).
Labordiagnostik
Die Gesamtheit dieser Enzyme wird als „alkalische Phosphatase“ bei Standard-Blutuntersuchungen gemessen und kann Hinweise auf vorliegende Krankheiten der Leber und des Skeletts liefern.
Die plazentare Isoform (PLAP) wird normalerweise durch plazentare Syncytiotrophoblasten produziert. Ihre Bestimmung wird bei Seminomen empfohlen. Die Halbwertszeit im Serum beträgt weniger als 3 Tage.
Referenzbereich
für Messungen bei 37 °C nach IFCC:
- Frauen: 105 U/l
- Männer: 130 U/l
Interpretation
Alkalische Phosphatasen sind in großer Menge im Skelettsystem, im Leberparenchym und in den Gallengangsepithelien vorhanden. Zu hohe Werte können ihre Ursache z. B. in Erkrankungen der Leber, der Gallenblase, der Schilddrüse oder der Bauchspeicheldrüse haben. Auch bei Knochenerkrankungen wie Osteomalazie, Morbus Paget, Rachitis, Knochenmetastasen, Hyperparathyreoidismus oder auch bei Knochenbrüchen ist der Wert der AP in der Regel erhöht. Eine der häufigsten Ursachen für eine AP-Erhöhung sind maligne Tumoren, die in den Knochen metastasiert sind (Knochenmetastasen).
Grundsätzlich weisen sowohl Kinder im Wachstum als auch Frauen im letzten Schwangerschaftsdrittel höhere aP-Werte auf; dies ist jedoch normal und liefert keinen grundsätzlichen Hinweis auf eine Erkrankung.
Ein zu niedriger Gehalt an alkalischer Phosphatase findet sich z. B. bei der seltenen Erbkrankheit Hypophosphatasie; darüber hinaus als Begleiterscheinung eines Vitamin-C-Mangels (Skorbut), als Folge einer Bypass-Operation, bei Schilddrüsen-Unterfunktion (Hypothyreose), Morbus Wilson, schwerer Blutarmut, Magnesiummangel und bei Einnahme von Kontrazeptiva.
Bei der CML finden sich erniedrigte alkalische Phosphatase-Werte in den Granulozyten.
Anwendung in der Biologie
In der Biochemie wird die Alkalische Phosphatase in Verbindung mit einem chromogenen Substrat für verschiedene Nachweismethoden (Färbungen) eingesetzt:
- Antikörperfärbung beim Western Blot zum Nachweis von Proteinen
- beim Northern Blot und Southern Blot zum Nachweis von RNA bzw. DNA
- bei der in situ-Hybridisierung zum Nachweis von RNA
Als chromogenes Substrat wird hierbei häufig BCIP in Verbindung mit NBT verwendet, welches von der Alkalische Phosphatase zu einem blauen Indigo-Farbstoff umgesetzt wird.
In der Molekularbiologie wird die Alkalische Phosphatase aus Kälberdarm (Calf Intestine Alkaline Phosphatase) und aus Garnelen (Shrimp Alkaline Phosphatase) zur Dephosphorylierung von linearer DNA eingesetzt.
Die gebräuchlichsten Alkalischen Phosphatasen sind:
- Bacterial Alkaline Phosphatase (BAP), aus Escherichia coli
- Calf Intestine Alkaline Phosphatase (CIAP), aus Kälberdarm
- Shrimp Alkaline Phosphatase (SAP), aus Eismeergarnelen (Pandalus borealis)
Literatur
- Neumeister; Besenthal; Liebrich: Klinikleitfaden Labordiagnostik, Urban&Fischer, München/Jena 2003, ISBN 3-437-22231-7
- Thomas, L.: Labor und Diagnose, TH-Books, Frankfurt am Main, 2005, ISBN 3-980-52155-9
- Sambrook, J.; Maniatis, T.; Russel, D.W.: Molecular cloning: a laboratory manual, Cold Spring Harbor Laboratory Press, 3rd edition 2001, ISBN 0-8796-9577-3
Siehe auch
Weblinks
Wikimedia Foundation.