- Western Blot
-
Western Blot (Westernblot), auch Immunblot (engl. Immunoblot) bezeichnet die Übertragung (engl. Blotting) von Proteinen auf eine Trägermembran, die anschließend über unterschiedliche Reaktionen nachgewiesen werden können. Die Übertragung kann auf unterschiedliche Weise durchgeführt werden: mittels Diffusion, Kapillarwirkung oder Elektrophorese. Anwendung findet der Western Blot in der molekularbiologischen und medizinischen Forschung sowie in der Diagnostik.
Die Western Blot-Methode wurde ursprünglich 1979 im Labor von George R. Stark an der Universität Stanford entwickelt.[1] Im selben Jahr konnten Harry Towbin und Mitarbeiter das Verfahren wie im einfacheren Southern Blot auf Nitrocellulose umstellen,[2] was auch heutzutage die einfachere und präferierte Methode ist.
Die Bezeichnung des Blot-Verfahrens („Western Blot“) stammt vom englischen blot für Klecks oder Fleck und von engl. blotting paper für Löschpapier, bei dem auch ein identischer Abdruck des Originals entsteht. Diese wurde erstmals 1981 von Neal Burnette[3] als eine Allusion eingeführt.[4] Edwin Southern gilt als der Erfinder der Blotting-Technik; 1975 entwickelte er die Methode für die Auftrennung von DNA-Fragmenten und nachfolgende Hybridisierung, die er als Southern Blot bezeichnete. Die entsprechende Auftrennung von RNA-Fragmenten wurde in Anlehnung an seinen Namen als Northern Blot bezeichnet. Daher nannte man das Proteinblotting als Western Blot. Einen Eastern Blot per se gibt es nicht, da es in der RNA/DNA/Protein-Familie keine weiteren Vertreter gibt. Dennoch wird der Ausdruck „Eastern Blot“ für verschiedene Methoden in Anspruch genommen, z. B für das Blotten von Lipiden auf Membranen, den Transfer nativer Proteine aus nichtdenaturierenden Gelen oder das Blotten von (sehr) kleinen Molekülen.[5]
Inhaltsverzeichnis
Methode
 Westernblot einer Nitrozellulosemembran, an die Proteine in unterschiedlichen Mengen (von links: 17 ng, 13 ng, 11 ng, 8 ng, 4 ng) fixiert wurden. Die Detektion erfolgte mit Hilfe eines zweiten Antikörpers, an den das Enzym Meerrettichperoxidase(HRP) gekoppelt wurde. Durch Chemilumineszenz wurde ein Film belichtet und entwickelt. Die Lumineszenzreaktion erfolgte in einer Lösung von 100 mM TRIS/HCl pH 6,8; 0,2 mM p-Cumarsäure (in Dimethylsulfoxid gelöst); 1,2 mM Luminol (Natriumsalz, in Dimethylsulfoxid gelöst) und 0,01 %iges Wasserstoffperoxid.
Westernblot einer Nitrozellulosemembran, an die Proteine in unterschiedlichen Mengen (von links: 17 ng, 13 ng, 11 ng, 8 ng, 4 ng) fixiert wurden. Die Detektion erfolgte mit Hilfe eines zweiten Antikörpers, an den das Enzym Meerrettichperoxidase(HRP) gekoppelt wurde. Durch Chemilumineszenz wurde ein Film belichtet und entwickelt. Die Lumineszenzreaktion erfolgte in einer Lösung von 100 mM TRIS/HCl pH 6,8; 0,2 mM p-Cumarsäure (in Dimethylsulfoxid gelöst); 1,2 mM Luminol (Natriumsalz, in Dimethylsulfoxid gelöst) und 0,01 %iges Wasserstoffperoxid.
Vor dem eigentlichen Western Blot wird ein Proteingemisch mit Hilfe einer Gel-Elektrophoresetechnik in einer Trägermatrix (SDS-PAGE, Nativ-PAGE, isoelektrische Fokussierung, 2D-Gelelektrophorese, usw.) entsprechend ihrer Größe, Ladung oder anderer Eigenschaften aufgetrennt. Hierbei werden die zu untersuchenden Proteine zuerst mit einem Gel (in der Regel ein Polyacrylamid-Gel mit optimaler Acrylamid-Konzentration) in Proteinbanden aufgetrennt.
Beim Western Blot wird ein senkrecht zum Polyacrylamid-Gel gerichtetes elektrisches Feld angelegt. Somit wandern die Proteine aus dem Gel auf eine Membran (Nitrocellulose, Nylon oder PVDF (Polyvinylidenfluorid)). An der Membranoberfläche bleiben sie aufgrund hydrophober Wechselwirkungen haften. Dabei bleibt das Muster der elektrophoretischen Auftrennung erhalten – die Proteine sind nun aber für weitere Methoden zugänglich (z. B. Antikörper-Bindung). Nach diesem Vorgang kann das an den Proteinen angelagerte SDS ausgewaschen werden. Daher können die Proteine renaturieren und teilweise ihre Sekundär- und Tertiärstruktur wieder einnehmen, nicht aber ihre Quartärstruktur. Für diese elektrophoretische Übertragung werden zwei unterschiedliche Systeme verwendet: das Tank-Blot-System und das Semidry-Blot-System, die sich in Aufbau und eingesetzten Puffermengen und -systemen unterscheiden.
Die Proteinbanden können nun auf der Membran mit Hilfe spezifischer Antikörper identifiziert werden. Spezifische Antikörper (monoklonal oder polyklonal) binden an der passenden Proteinbande auf der Membran. Unspezifisch gebundene Antikörper werden aufgrund von Waschschritten mit Puffern, die Detergentien enthalten, wieder entfernt. Weil die Renaturierung nicht vollständig ist, können bei Verwendung monoklonaler Antikörper, die spezifisch nur ein Epitop am Protein erkennen, Probleme auftreten.
Die Gesamtheit der membrangebundenen Proteine kann aber auch über alternative Methoden detektiert werden. Über bestimmte Farbstoffe wie Coomassie, Ponceau S, Kolloidales Gold, Amidoschwarz oder Tusche werden alle Proteine unspezifisch markiert. Andere Farbstoffe sind in der Lage, alle phosphorylierten Proteine zu markieren. Je nach Versuchsaufbau können einzelne Proteine auch direkt sichtbar gemacht werden, z. B. radioaktiv markierte Proteine (z. B. durch den Einbau von Isotopen bei der Proteinsynthese oder Phosphorylierung) oder bei Enzymen durch Umsetzen des entsprechenden Substrats.
Immundetektion
Am häufigsten werden Proteine über eine Immundetektion visualisiert. Dabei macht man sich das Antigen-Antikörper-Bindungs-Prinzip zunutze: Ein antigenspezifischer Primärantikörper bindet an „sein“ Epitop auf dem Antigen (hier: einer aufgetrennten Proteinmischung). An die Fc-Region des primären Antikörpers bindet wiederum ein sekundärer Markierungsantikörper, über den dann die Detektion erfolgt.
Je nach Fragestellung kann beim Immunblot – wie unten beschrieben - das Antigen oder – wie z. B. beim HIV-Immunblot – auch der Primärantikörper das Suchobjekt sein. Bemerkung: Auch Antikörper sind Proteine, und man kann sich ihre antigenen Eigenschaften z. B. für Immunblot und ELISA zunutze machen.
Ein typischer Western Blot kann folgendermaßen aussehen:
- Nach dem Transfer (Elektrophorese und Blot) der Proteine auf die Membran müssen zuerst die freien Bindungsstellen auf der Membran blockiert werden, da sich sonst die Antikörper an diese Bindungstellen heften und einen spezifischen Nachweis von Antigenen unmöglich machen würden. Das Blockieren der freien Bindungsstellen erfolgt mit einem für die Antikörper nicht erkennbaren Protein oder chemischen Polymer. Dafür eignen sich Lösungen von Milchpulver, Rinderserumalbumin (BSA, bovine serum albumin), Gelatine und andere Proteine. Wurde zusätzlich zu den zu untersuchenden Proteinen ein Größenmarker verwendet, sollte zuerst eine Färbung der Membran bzw. aller Proteine mit z. B. Ponceau S erfolgen. Die anschließend sichtbaren Markerbanden können mit mechanischen Druck auf die Membran erhalten werden und so auch noch nach der Farbreaktion durch das an den sekundären Antikörper gekoppelten Enzym zur Proteinidentifizierung herangezogen werden.
- Die Membran wird nun mit einer verdünnten Antikörper-Lösung behandelt, wobei die Antikörper spezifisch gegen das Protein auf der Membran gerichtet sind.
- Einige Waschschritte entfernen schwächer haftende, unspezifisch gebundene Antikörper von der Membran. Eine zweite Antikörperlösung (mit dem Sekundär-Antikörper) wird auf die Membran gegeben, deren Antikörper spezifisch gegen bestimmte Bereiche des ersten Antikörpers gerichtet sind (in der Regel die Fc-Bereiche des Antikörpers) und bindet an diesen.
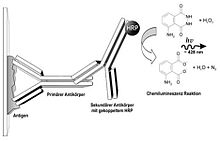 Schema der Immundetektion. Der primäre Antikörper bindet an sein Antigen, welches auf einer Membran fixiert ist. An diesen wiederum bindet der sekundäre Antikörper, der z. B. mit dem Enzym HRP gekoppelt ist. HRP katalysiert die Umsetzung von Luminol in seine oxidierte Form, dessen Chemilumineszenz detektiert werden kann.
Schema der Immundetektion. Der primäre Antikörper bindet an sein Antigen, welches auf einer Membran fixiert ist. An diesen wiederum bindet der sekundäre Antikörper, der z. B. mit dem Enzym HRP gekoppelt ist. HRP katalysiert die Umsetzung von Luminol in seine oxidierte Form, dessen Chemilumineszenz detektiert werden kann.
- Nach weiteren Waschschritten erfolgt nun je nach Detektionsmethode die Sichtbarmachung. Bei Enzym-Antikörper-Konjugaten wird durch das Enzym eine Farb- oder Chemilumineszenzreaktion katalysiert. Ein häufig an sekundäre Antikörper gekoppeltes Enzym ist beispielsweise die Meerrettichperoxidase (HRP, horseradish peroxidase, also eine Peroxidase aus dem Meerrettich). Diese HRP katalysiert die Umsetzung von Luminol (bzw. dessen Derivate) in seine oxidierte Form, bei der eine Lumineszenz detektiert werden kann. Auch alkalische Phosphatasen (AP) werden häufig verwendet. Der Nachweis erfolgt dabei durch eine Farbreaktion mit dem artifiziellen Substrat BCIP und NBT. Bei radioaktiv markierten Zweitantikörpern erfolgt der Nachweis durch Autoradiographie auf Röntgenfilmen. Weiterhin existieren auch Sekundär-Antikörper mit Fluoreszenzkonjugaten, die an speziellen Scannern direkt detektiert werden können. Hierbei können dann auch Doppelmarkierungen auf derselben Membran durchgeführt werden, wenn zwei unterschiedliche Primär-Antikörper (z. B. aus der Maus und der Ziege) unterschiedlicher Spezifität mit den entsprechenden Sekundär-Antikörper (z. B. Anti-Maus IgG und Anti-Ziege IgG) mit unterschiedlichen Fluoreszenzfarbstoffen eingesetzt werden.
Diese zweistufige Detektion hat mehrere Vorteile. Dadurch, dass mehrere Sekundärantikörper an einen Primärantikörper binden können, kommt es zu einer Signalverstärkung. Der Sekundärantikörper ist meist ein Antikörper breiterer Spezifität, der alle Primär-Antikörper einer Spezies erkennt (z. B. alle Antikörper, die aus Mäusen stammen), dadurch ist er universeller einsetzbar. Der Sekundärantikörper kann bereits an ein Enzym gekoppelt sein, derartige Antikörperkonjugate sind im Handel erhältlich.
Immunblot vs. (EL)ISA
Beides sind Methoden, die zum Nachweis von Antigenen (Proteinen) mit Hilfe markierter Antikörper dienen: Beide sind damit ISAs (Immunosorbent Assay), Methoden aus dem Bereich der Proteomik.
Doch der Immunblot erweitert den ELISA gewissermaßen um eine Dimension: durch die Gelelektrophorese und die Fixierung auf einem Festmedium (dem Blot) stehen den Antikörpern an verschiedenen, definierten Orten unterschiedliche Antigene zur „Auswahl“: Ein einziger Immunblot kann z. B. ein Serum mittels einer Vielzahl aufgeblotteter Antigene auf ebendiese Vielzahl an zugehörigen Antikörpern überprüfen; in der Labormedizin eine ungeheure Vereinfachung.
Anwendungen
Im Bereich der Proteinbiochemie dient der Western Blot zum Nachweis von bestimmten Proteinen und Protein-Veränderungen, z. B. Phosphorylierung. Es kann auch eine semiquantitative Analyse durchgeführt werden (Probe A enthält mehr Protein X als Probe B).
Im Bereich der Medizin dient das Western Blotting dem Nachweis diagnostisch interessanter Proteine, so zum Beispiel von Antikörpern im Serum, welche für das Vorliegen bestimmter Infektionskrankheiten typisch sein können. Mittels des Western Blots kann man Teststreifen herstellen, um z. B. Antikörper gegen bestimmte Viren im Serum nachzuweisen. Außerdem hilft diese Methode in der medizinischen Forschung bei der Suche nach krankheitsrelevanten Proteinen z. B. dem BSE-Erreger oder HIV.
Auch Proteine wie die EKR, die gehäuft in Tumoren vorkommen, können über Western Blot quantifiziert und entartete Zellen hierdurch erkannt werden. Hiermit kann z.B. bestimmt werden, inwiefern sich bestimmte Medikamente regulativ auf die vermehrte Expression solcher Proteine in der Zelle auswirken und somit eine regulative Wirkung auf das weitere Wachstum der Tumorzellen haben.
Siehe auch
Einzelnachweise
- ↑ Renart, J. et al. (1979): Transfer of proteins from gels to diazobenzyloxymethyl-paper and detection with antisera: a method for studying antibody specificity and antigen structure. In: Proc. Natl. Acad. Sci. U. S. A. Bd. 76(7), S. 3116–3120. PMID 91164. PDF (freier Volltextzugriff)
- ↑ Towbin, H. et al. (1979): Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. In: Proc. Natl. Acad. Sci. U. S. A. Bd. 76(9), S. 4350–4354. PMID 388439 PDF (freier Volltextzugriff)
- ↑ Burnette, W.N. (1981): Western blotting: electrophoretic transfer of proteins from sodium dodecyl sulfate -polyacrylamide gels to unmodified nitrocellulose and radiographic detection with antibody and radioiodinated protein A. In: Anal. Biochem. Bd. 112(2), S. 195–203. PMID 6266278; doi:10.1016/0003-2697(81)90281-5
- ↑ Citation's Classic: W. Neal Burnette
- ↑ Tanaka H. et al. (2007): Eastern blotting and immunoaffinity concentration using monoclonal antibody for ginseng saponins in the field of traditional chinese medicines. J Agric Food Chem.; 55(10):3783–3787; PMID 17455950 PDF (freier Volltextzugriff)
Weblinks
- Westernblot auf antikörper-online
- Erstellen der eigenen Chemilumineszenzlösung (Luminol) für Western Blots (in Laborjournal vom 10. Juni 2005)
Wikimedia Foundation.