- Indoxyl
-
Strukturformel 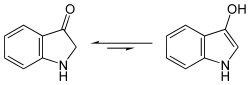
Allgemeines Name Indoxyl Andere Namen - 3-Indolinon (Keto-Form)
- 3-Hydroxyindol (Enol-Form)
Summenformel C8H7NO CAS-Nummer 480-93-3 PubChem 50591 Kurzbeschreibung hellgelbe Kristalle [1]
Eigenschaften Molare Masse 133,15 g·mol−1 Aggregatzustand fest
Schmelzpunkt Löslichkeit löslich in Wasser, Alkalien, Ethanol und Diethylether[1]
Sicherheitshinweise EU-Gefahrstoffkennzeichnung [2] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Indoxyl ist ein Derivat des Indols und wird als eine Farbstoff-Vorstufe bei der natürlichen und synthetischen Herstellung von Indigo verwendet.
Indoxyl entsteht bei der Hydrolyse des in Pflanzen vorkommenden Glykosids Indican (Indoxyl-β-D-glucosid) durch Gärung (siehe Indigogewinnung).
Inhaltsverzeichnis
Herstellung
Im Zuge der Indigosynthese haben der Chemiekonzern BASF und die Hoechst AG die sogenannte Heumann-Pfleger-Synthese entwickelt. Dabei wird aus Anthranilsäure Indoxyl gewonnen:
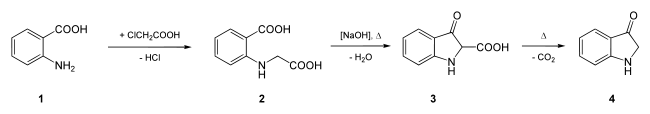 Synthese Indoxyls. Anthranilsäure (1) reagiert dabei mit Chloressigsäure zu Phenylglycin-o-carbonsäure (2). In der Natronschmelze entsteht daraus 2-Indoxycarbonsäure (3), was nach Decarboxylierung Indoxyl (4) ergibt.
Synthese Indoxyls. Anthranilsäure (1) reagiert dabei mit Chloressigsäure zu Phenylglycin-o-carbonsäure (2). In der Natronschmelze entsteht daraus 2-Indoxycarbonsäure (3), was nach Decarboxylierung Indoxyl (4) ergibt.
Eigenschaften
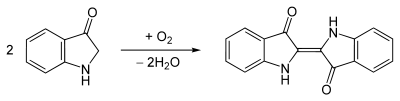
Im alkalischen Medium wird das wasserlösliche, gelbe Indoxyl durch den Sauerstoff der Luft zum wasserunlöslichen, dunkelblauen Farbstoff (Pigment) Indigo oxidiert. Dabei werden vier Elektronen (e−) und vier Protonen (H+) auf ein Sauerstoff-Molekül übertragen.
Indoxyl zeigt in wäßriger Lösung eine gelbgrüne Fluoreszenz.[1] Indoxyl liegt im Gleichgewicht mit einer Enol-Form und einer Keto-Form (Keto-Enol-Tautomerie). Spektroskopische Befunde zeigen aber, dass bei Indoxyl dieses Gleichgewicht nahezu vollständig zur Keto-Form verschoben ist.[3]
Verwendung
Einige synthetische Indoxyl-Derivate finden Anwendung in der Biochemie:
- BCIP auch X-Phos (5-Brom-4-chlor-3-indoxylphosphat)
- X-Gal (5-Brom-4-chlor-3-indoxyl-β-D-galactopyranosid)
- X-Gluc (5-Brom-4-chlor-3-indolyl-β-D-glucuronsäure)
Einzelnachweise
- ↑ a b c d Thieme Chemistry (Hrsg.): Römpp Online. Version 3.1. Georg Thieme Verlag, Stuttgart 2007.
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Wittko Francke und Wolfgang Walter: Lehrbuch der Organischen Chemie. S. Hirzel Verlag Stuttgart; 24. überarb Auflage 2004, ISBN 3-7776-1221-9; S. 776
Siehe auch
Wikimedia Foundation.